Tegafur
Tegafur (INN) ist ein Arzneistoff, der als Zytostatikum in der Chemotherapie von metastasiertem Krebs besonders von Magen-, Darm- und Brustkrebs eingesetzt wird.[4] Der Wirkstoff gehört zur Gruppe der Nucleosid-Analoga. In der Leber wird es in 5-Fluoruracil (5-FU) umgewandelt und ist somit ein Prodrug, das im Gegensatz zu 5-FU peroral verabreicht werden kann.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-Tegafur_Structural_Formulae_V.1.svg.png.webp) | ||||||||||||||||||||||
| 1:1-Gemisch aus (R)-Form (links) und (S)-Form (rechts) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Tegafur | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C8H9FN2O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01BC03 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 200,17 g·mol−1 | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Tegafur wird auch in Kombination mit Uracil, mit dem die Verbindung ein 1:1-Addukt bildet, gegeben. Das Uracil hemmt dabei das 5-FU-abbauende Enzym Dihydropyrimidindehydrogenase (DPD).
Stereoisomerie
Tegafur enthält ein stereogenes Zentrum und ist somit chiral, es gibt also zwei Enantiomere, (R)-5-Fluor-1-(tetrahydro-2-furyl)-uracil und das spiegelbildliche (S)-5-Fluor-1-(tetrahydro-2-furyl)-uracil. Der Arzneistoff Tegafur wird als Racemat [1:1-Gemisch aus (R)-5-Fluor-1-(tetrahydro-2-furyl)-uracil und (S)-5-Fluor-1-(tetrahydro-2-furyl)-uracil] eingesetzt, obwohl, die unterschiedliche Pharmakodynamik von Arzneistoff-Enantiomeren – von seltenen Ausnahmen abgesehen – bekannt ist.[5]
Synthese
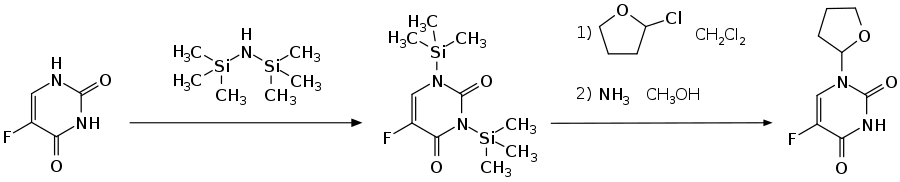
Die Synthese von Tegafur geht vom 5-Fluoruracil aus, welches im ersten Schritt mittels Hexamethyldisilazan an den Amidfunktionen silyliert wird. Die Einführung der Tetrahydrofuranylgruppe erfolgt durch die Umsetzung mit 2-Chlortetrahydrofuran. Das Zielmolekül wird dann durch Abspaltung der Trimethylsilylgruppe mittels methanolischer Ammoniaklösung erhalten.[3][6]
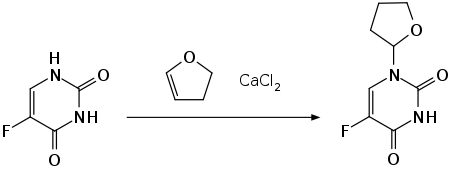
Bei einer zweiten Synthesvariante wird 5-Fluoruracil direkt mit 2,3-Dihydrofuran in Gegenwart von Calciumchlorid und Pyridin zum Tegafur umgesetzt.[3]
Beide Synthesesequenzen ergeben das Racemat.
Eigenschaften
Racemisches Tegafur tritt in vier polymorphen Formen auf. Die α–, β– und δ–Formen können durch Lösungsmittelkristallisation erhalten werden. Die γ–Form bildet sich nach enantiotropen Umwandlungen aus der α– bzw. β–Form bei 162 °C bzw. 120 °C und schmilzt dann bei 175 °C. Die δ–Form zeigt einen Schmelzpunkt bei 165 °C.[1] Für die α– und β–Form sind mittels Röntgeneinkristalluntersuchungen die Kristallstrukturen untersucht worden. Die α–Form kristallisiert in einem triklinen Kristallgitter mit der Raumgruppe P1 (Raumgruppen-Nr. 1).[7][8] Für die β–Form wurde ein monoklines Kristallgitter mit der Raumgruppe P21/n (Nr. 14, Stellung 2) bestimmt.[9] Beide Formen bilden im Kristallgitter über Wasserstoffbrücken verknüpfte Dimere aus. Der Unterschied besteht darin, dass bei der α–Form eine Verknüpfung über die N-H-Gruppe und die harnstoffanaloge Carbonylstruktur und bei der β–Form diese über die N-H-Gruppe und die säureamidanaloge Carbonylstruktur erfolgt.[9]
Einzelnachweise
- T. Uchida, E. Yonemochi, T. Oguchi, K. Terada, K. Yamamoto, Y. Nakai: Polymorphism of Tegafur: Physico-chemical Properties of Four Polymorphs. In: Chem. Pharm. Bull. 41, 1993, S. 1632–1635.
- Datenblatt Tegafur bei Sigma-Aldrich, abgerufen am 23. April 2011 (PDF).
- A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances – Synthesis, Patents, Applications. 4. Auflage. Thieme-Verlag Stuttgart 2000, ISBN 1-58890-031-2.
- N. I. Karev, N. G. Blokhina, E. K. Vozny, M. P. Pershin: Experience with ftorafur treatment in breast cancer. In: Neoplasma. 19, 1972, S. 347–350.
- E. J. Ariëns: Stereochemistry, a basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology. In: European Journal of Clinical Pharmacology. 26, 1984, S. 663–668, doi:10.1007/BF00541922.
- E. Lukevits, A. Zablotskaya: Synthesis of Ftorafur (review). In: Chemistry of Heterocyclic Compounds. 27, 1992, S. 1271–1299, doi:10.1007/BF00515572.
- Y. Nakai, K. Yamamoto, K. Terada, T. Uchida, N. Shimizu, S. Nishigaki: The Crystal Structure of Ftorafur. In: Chem. Pharm. Bull. 30, 1982, S. 2629–2632, doi:10.1248/cpb.30.2629, (pdf)
- F. Needham, J. Faber, T. G. Fawcett: X-ray powder diffraction analysis of tegafur. In: Powder Diffraction. 21, 2006, S. 245–247, doi:10.1154/1.2210952.
- Y. Nakai, K. Yamamoto, K. Terada, T. Uchida, K. Yamaguchi, N. Shimizu: The crystal Structure of Tegafur (β–Form): Comparison with α–Form. In: Chem. Pharm. Bull. 34, 1986, S. 1242–1248, doi:10.1248/cpb.34.1242, (pdf)
Literatur
- H. J. Roth, H. Fenner: Arzneistoffe. Thieme, Stuttgart/ New York 1988, ISBN 3-13-673501-3, S. 198–199.
Handelsnamen
- D,CH UFT® (Merck KGaA) für das Tegafur-Uracil-Addukt
- I Citofur (Lusofarmaco)
- J Coparogin (Nippon Chemiphar)
- J Flulaid (Takeda)