Bodroux-Amid-Synthese
Die Bodroux-Amid-Synthese oder Bodroux-Reaktion ist eine Namensreaktion der organischen Chemie. Sie wurde 1904[1] von Fernand Bodroux (1873–1968) veröffentlicht. Mit Hilfe dieser Reaktion kann man substituierte Amide aus aromatischen oder aliphatischen Estern (R = Alkylrest, Arylrest) und einem Aminomagnesiumhalogenid (R1= H, Alkylrest, Arylrest; R = Alkylrest, Arylrest) herstellen:
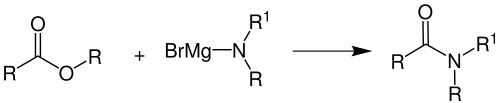
Der Vorteil dieser Reaktion gegenüber der alternativen Aminolyse ist, dass sie keine hohe Temperatur oder hohen Druck benötigt.[2] Aminomagnesiumhalogenide können durch Aufarbeitung eines primären oder sekundären Amines mit einer Grignard-Verbindung bereits bei Raumtemperatur erzeugt werden.[3] Nennenswert ist außerdem noch, dass das Magnesium durch Alkalimetalle, Aluminium, Zinn oder Titan ersetzt werden kann, sowie das hier exemplarisch genutzte Brom durch Chlor oder Iod.[3] Dadurch ist die Bodroux-Amid-Synthese besonders aus wirtschaftlicher Sicht eine wichtige Reaktion.
Nachteilig gegenüber der alternativen Aminolyse ist die Bildung stöchiometrischer Mengen von anorganischen Salzen, z. B. Magnesiumsalzen. Die Atomökonomie der Bodroux-Amid-Synthese ist also ungünstiger als die Aminolyse.
Mechanismus
Der Mechanismus soll hier exemplarisch mit Magnesiumbromid dargestellt werden. Bei diesem Mechanismus handelt es sich um denselben wie bei der Reaktion einer Grignard-Verbindung mit einem Ester.[3]
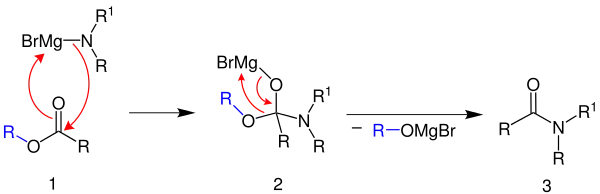
Zunächst versetzt man einen Ester 1 (R = Alkylrest, Arylrest) mit einem Magnesiumbromamin. Durch Umlagerung von Elektronenpaaren lagert sich das Organylmagnesiumbromid (R1= H, Alkylrest, Arylrest; R = Alkylrest, Arylrest) an das Sauerstoffatom und der Stickstoff des Amins an das Kohlenstoffatom der Carbonylgruppe an. Dadurch erhält man das Amin 2. Nun findet ein intramolekularer Angriff der Alkoxygruppe auf das Magnesiumbromid statt. Dabei scheidet sich ein Magnesiumsalz ab und es entsteht das gewünschte Amid 3.[3]
Modifizierungen
Die Bodroux-Amid-Synthese besitzt eine Vielzahl von Modifizierungen.
- Eine dieser Modifizierungen ist die Reaktion von Estern und Lithium-Aluminium-Amiden [LiAl(NH2)4]. Sie verläuft in Diethylether bereits bei 25 °C. Durch diese niedrigen Temperaturen ist sie sehr energiesparsam und somit wirtschaftlich sehr attraktiv.[2]
- Eine weitere Modifizierung stellt die Reaktion eines Carboxylates mit einem Amin und einer Grignard-Verbindung dar.[4] Diese Modifizierung ist im Folgenden anhand eines Beispiels dargestellt:[4]
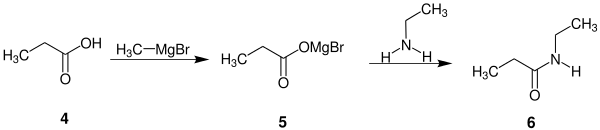
Bei dieser Modifizierung wird zunächst aus Propionsäure (4) mit einer Grignard-Verbindung ein Carboxymagnesiumbromid 5 erzeugt. Durch Zugabe von Ethylamin erhält man dann das gewünschte N-Ethylpropionsäureamid (6).
Siehe auch
Einzelnachweise
- M. F. Bodroux: Nouvelle methode de preparation des anilides. In: Comptes Rendus. Band 138, 1904, S. 1427–1429.
- A. Solladie-Cavallo, M. Bencheqroun: Inexpensive reagents for the synthesis of amides from esters and for regioselective opening of epoxides. In: The Journal of Organic Chemistry. Band 57, Nr. 22, 1992, S. 5831–5834, doi:10.1021/jo00048a011.
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 445–446.
- C. Aubert, C. Huard-Perrio, M. C. Lasne: Rapid synthesis of aliphatic amides by reaction of carboxylic acids, Grignard reagent and amines: application to the preparation of [11C]amides. In: Journal of the Chemical Society. Band 19, 1997, S. 2837–2842, doi:10.1039/A702897K.