Bodenchemie
Bodenchemie ist eine Spezialdisziplin an der Schnittstelle von Chemie und Bodenkunde, die den stofflichen Aufbau, die Verteilung, die Stabilität und die Kreisläufe von chemischen Elementen und Verbindungen in Böden (unter Berücksichtigung des Kontaktes mit Wasser sowie der Erdatmosphäre) thematisiert. Berücksichtigt wird, dass sich unter gewissen Voraussetzungen Mikroorganismen in Böden entwickeln, dass in Böden organische Bodensubstanz vorhanden sein kann und dass Böden Teil einer umfassenderen Biosphäre sind. Der Themenfokus der Bodenchemie liegt auf den chemischen Eigenheiten unterschiedlicher Böden, welche in der Natur angetroffen werden, und auf deren Verhalten unter den diversen Einflüssen ihrer Umwelt, inklusive der menschlichen Eingriffe in diese. Es sind insbesondere Phänomene der physikalischen Chemie, die in Böden eine erhebliche Rolle spielen. Sämtliche bekannten, in Böden vorkommenden chemischen und mineralogischen Verbindungen sowie Reaktionen und bodenbildenden Prozesse sind Teil des Themenspektrums.
Grundbegriffe der Bodenchemie
Bodenstruktur
Die Bodenstruktur thematisiert, wie einzelne Bodenpartikel entstehen, wie sie zusammengruppiert werden, um Cluster von Partikeln zu bilden, die als Gemenge oder Aggregate bezeichnet werden.
Mineralien
- Die mineralischen Bestandteile des Bodens stammen aus den Ausgangsgesteinen oder dem Regolith. Die Mineralien machen etwa 90 % des Gesamtgewichts des Bodens aus. Einige wichtige Elemente, die im zusammengesetzten Zustand vorkommen, sind O, Fe, Si, Al, N, P, K, Ca, Mg, C, H usw.
- Die Bildung von primären und sekundären Mineralien definiert genauer, welche Mineralien im Gesteinsgefüge enthalten sind.
Bodenporen
Die Wechselwirkungen der Mikroporen und Makroporen des Bodens sind wichtig für die Bodenchemie, da sie die Bereitstellung von Wasser und gasförmigen Elementen für den Boden und die umgebende Atmosphäre ermöglichen. Makroporen hilft beim Transport von Molekülen und Substanzen in und aus den Mikroporen. Mikroporöses Material ist in den Aggregaten selbst enthalten.
Bodenwasser
- Wasser ist für Organismen im Bodenprofil unerlässlich und füllt die Makroporen in einem idealen Boden teilweise auf.
- Auslaugung des Bodens tritt auf, wenn Wasser Ionen mit sich trägt, die tiefer in die unteren Bodenhorizonte eindringen, wodurch der Boden in anderen Bodenhorizonten stärker oxidiert wird.
- In Böden wird das Wasser üblicherweise von Orten mit einem höheren hydraulischen Potenzial zu Orten mit einem niedrigeren fließen; dies kann zu Kapillaraktivität im Boden führen, welche seitens der Adhäsion des Wassers mit der Poren-durchsetzten Bodenoberfläche, seitens gravitativer Kräfteeinflüsse sowie seitens Kohäsion maßgeblich beeinflusst wird. Durch intermolekulare Kräfte besteht Kohäsion zwischen den Wassermolekülen – gemeint sind hier die sogenannten „Wasserstoffbrückenbindungen“; ihr Einfluss ist in diesem Zusammenhang gegeben.
Luft/Atmosphäre
Die Atmosphäre enthält drei Hauptgase, nämlich Sauerstoff, Kohlendioxid und Stickstoff. In der Atmosphäre beträgt Sauerstoff 20 %, Stickstoff 79 % und CO2 0,15 bis 0,65 Vol.-%. CO2 steigt mit zunehmender Bodentiefe aufgrund der Zersetzung angesammelter organischer Stoffe und der Fülle von Pflanzenwurzeln. Das Vorhandensein von Sauerstoff im Boden ist wichtig, da er beim Abbau unlöslicher Gesteinsmasse in lösliche Mineralien und organische Humifizierung hilft. Luft im Boden besteht aus Bodengasen, die in der Atmosphäre vorhanden sind, aber nicht in denselben Anteilen. Diese Gase erleichtern chemische Reaktionen in Mikroorganismen. Die Ansammlung löslicher Nährstoffe im Boden macht ihn produktiver. Wenn der Boden sauerstoffarm ist, wird die mikrobielle Aktivität verlangsamt oder eliminiert. Wichtige Faktoren, die die Bodenatmosphäre steuern, sind Temperatur, Luftdruck, Wind/Belüftung und Niederschläge.
Bodenbeschaffenheit
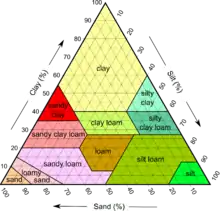
Die Bodentextur beeinflusst die Bodenchemie im Hinblick auf die Fähigkeit des Bodens, seine Struktur aufrechtzuerhalten, auf die Einschränkung des Wasserflusses und auf den Inhalt der Partikel im Boden. Die Bodentextur berücksichtigt alle Partikeltypen; und ein Bodentexturdreieck ist ein Diagramm, das verwendet werden kann, um die Prozentsätze jeder Partikelart zu berechnen, die sich insgesamt zu 100 % für das Bodenprofil summieren. Diese Bodenseparatoren unterscheiden sich nicht nur in ihrer Größe, sondern auch in ihrem Einfluss auf einige der wichtigen Faktoren, die das Pflanzenwachstum beeinflussen, wie Bodenbelüftung, Arbeitsfähigkeit, Bewegung und Verfügbarkeit von Wasser und Nährstoffen.
Sand
Die Größe der Sandpartikel variiert (ca. 0,05 mm bis 2 mm). Sand ist die gröbste der Partikelgruppen unter dem, was man noch als „Partikel“ gelten lässt. Sand hat die größten Poren und Bodenpartikel der Partikelgruppen. Es entleert sich auch am leichtesten. Diese Partikel werden stärker an chemischen Reaktionen beteiligt, wenn sie mit Ton beschichtet werden.
Schluff
Schluffpartikel haben eine unterschiedliche Größe (etwa 0,002 mm bis 0,5 mm). Schluffporen gelten im Vergleich zu den anderen Partikelgruppen als mittelgroß. Schluff hat eine Texturkonsistenz von Mehl. Schluffpartikel lassen Wasser und Luft leicht passieren, halten aber die Feuchtigkeit für das Pflanzenwachstum zurück. Schluffiger Boden enthält ausreichende Mengen an organischen und anorganischen Nährstoffen.
Ton
Ton hat Partikel mit der kleinsten Größe (etwa < 0,002 mm) der Partikelgruppen. Ton hat auch die kleinsten Poren, die ihm eine größere Porosität verleihen, und er entwässert nicht gut. Ton hat eine klebrige Textur, wenn er nass ist. Einige Arten können wachsen und sich auflösen oder mit anderen Worten schrumpfen und anschwellen.
Lehm
Lehm ist eine Kombination aus Sand, Schluff und Ton. Ersterer kann basierend auf den Primärpartikeln in der Bodenzusammensetzung charakterisiert werden, etwa als „sandiger Lehm“, „toniger Lehm“, „schluffiger Lehm“ usw.
Biota
Als Organismen tragen Biota zusammen mit organischem Material dazu bei, das biologische System des Bodens zu bilden.
Organische Bodensubstanz
Organische Bodensubstanz ist ein zusammenfassender Begriff für die organische Substanz im Boden. Sie besteht aus:
In Mineralböden besteht die organische Substanz durchschnittlich zu 85 % aus Humus, zu etwa 10 % aus Pflanzenwurzeln und zu ungefähr 5 % aus Edaphon (Bodenflora und Bodenfauna)[1]. Der Humus kann wiederum in Huminstoffe und Nicht-Huminstoffe, sogenannte Streustoffe, eingeteilt werden.
Umfassendere Konzepte und Themen der Bodenchemie
Im Folgenden seien noch eine Reihe von umfassenderen Konzepten und Themen der Bodenchemie aufgezählt, von denen einige in den untenstehenden Abschnitten thematisiert werden:
- Anionen- und Kationenaustauschkapazität,
- Boden-pH,
- Mineralbildungs- und -umwandlungsprozesse und Pedogenese,
- Tonminerale,
- Sorptions- und Niederschlagsreaktionen im Boden,
- Chemie von Problemböden,
- C/N-Verhältnis,
- Erosion und Bodendegradation.
Ein Blick auf ausgewählte Basisthemen der Bodenchemie: Prozesse und Bodeneigenschaften
Physikochemische Prozesse in Böden: Austauschvorgänge und dergleichen
Eine der wichtigsten Eigenschaften des Bodens ist seine Fähigkeit, Ionen (z. B. Nährstoffe) festhalten (=sorbieren) und bei Bedarf abgeben zu können.[2]
Die Nährstoffanlagerung findet an den Oberflächen der mineralischen und organischen Bodenteilchen (Sorptionskomplex) statt, hauptsächlich an den Kolloiden (Tonminerale, Huminstoffe).[2]
Ionenaustausch
Die Nährstoffabgabe erfolgt durch einen Austausch von Ionen, z. B. 1 Calciumion (Ca2+) gegen 2 Ionen Wasserstoff (H+). Durch Nährstoffentzug und Auswaschung vermindert sich nicht die Menge der im Boden gebundenen Ionen, aber ihr Verhältnis zueinander. Die Gesamtmenge an Ionen, die ein Boden austauschbar gebunden enthält, nennt man seine Austauschkapazität (AK). Man meint damit seine Austauschkapazität für Kationen (KAK), die den weit überwiegenden Teil der austauschbaren Ionen ausmacht. Die wichtigsten austauschbaren Kationen sind Calcium (Ca2+), Magnesium (Mg2+), Kalium (K+) und Natrium (Na+). Mit zunehmender Bodenversauerung treten an ihre Stelle Wasserstoff und Aluminium (Al3+). Für den Stickstoffhaushalt der Böden ist es wichtig, dass auch das Ammonium-ion (NH4+) sorbiert und damit vor Auswaschung geschützt wird. Die Austauschkapazität für Anionen (AAK) ist sehr viel geringer als die für Kationen. Für die Pflanzenernährung wichtige austauschbare Anionen sind die Phosphat- (PO43−), Sulfat- (SO42−), Nitrat- (NO3−) und Chloridionen (Cl−). Die beiden letztgenannten werden nur sehr schwach gebunden und daher leicht ausgewaschen. Das gilt im abgeschwächten Maß auch für das Sulfation.[2]
Basensättigung
Die Kationen Calcium, Magnesium, Kalium und Natrium werden als basische Kationen (Basen) bezeichnet. Ihren prozentualen Anteil an der Austauschkapazität bezeichnet man als Basensättigung. Von Böden mit hoher Basensättigung spricht man, wenn der Anteil basischer Kationen mehr als 70 %, von geringer, wenn er weniger als 30 % beträgt. Werden dem Boden von außen Ionen zugeführt (z. B. durch Säuren oder Düngesalze), so wird ein Teil der sorbierten Ionen ausgetauscht.[2]
pH-Wert
Der pH-Wert ist ein Maß für den Säuregrad (Azidität) eines Bodens oder die Bodenreaktion. Böden des humiden Klimabereiches weisen pH-Werte im Bereich von 3,0 (sehr stark sauer) bis etwa 7,5 (schwach alkalisch) auf. Die pH-Zahlen sind die vereinfachte Schreibweise für die Menge an freien Wasserstoffionen in einem Liter Wasser. Mit jeder pH-Stufe nimmt die Konzentration an Wasserstoffionen um den Faktor 10 ab. Bei pH 3 befinden sich 10−3 (0,001) mol H+-Ionen in 1 l Bodenlösung.[3]
Versauerung
Abnehmende pH-Zahlen kennzeichnen eine Zunahme der Wasserstoff-Ionenkonzentration, die man als Bodenversauerung bezeichnet. Ursachen der Versauerung sind:[3]
- Die H+-Ionenproduktion als Folge der Atmung (CO2-Ausscheidung) von Wurzeln und Mikroorganismen. Durch die Bodenatmung entstehen auf landwirtschaftlich genutzten Flächen etwa 10 kg H+-Ionen/ha und Jahr. Zu deren Neutralisation werden 500 kg Calciumcarbonat/ha benötigt.
- Das Entstehen organischer Säuren bei der Humifizierung (Bildung von Huminsäuren), aber auch bei behindertem Abbau organischer Masse infolge Luftmangels (Bildung von Milchsäure, Buttersäure u. a.). Durch schlecht eingepflügtes Rübenblatt können z. B. bis zu 10 kg H+-Ionen/ha freigesetzt werden.
- Die Umsetzung von physiologisch sauren Düngemitteln, z. B. Ammoniumsulfat. 100 kg Stickstoff, als Ammonium-Stickstoff gedüngt, können bis zu 7 kg H+-Ionen/ha freisetzen. Die äquivalente Kalkmenge beträgt 350 kg Calciumcarbonat.
- Säureeinträge aus der Atmosphäre (Saurer Regen). Der Anteil des sauren Regens am Gesamtsäureeintrag wird häufig überschätzt. Er macht in landwirtschaftlich genutzten Böden meist weniger als 10 %, in forstlich genutzten Böden allerdings bis zu 60 % aus.
Der Säuregrad eines Bodens hat für Bodenentwicklung, Bodeneigenschaften und Pflanzenwachstum vielfache Bedeutung. Mit dem Absinken der pH-Werte ursprünglich basenreicher Böden beginnen die Tonwanderung und der Strukturzerfall. Die biologische Aktivität geht zurück. Phosphorsäure wird festgelegt. Bei stärkeren Säuregraden (pH unter 5,0) treten in Mineralböden freie Al3+-Ionen und Schwermetalle auf, die auf das Wachstum der Kulturpflanzen mehr oder weniger giftig wirken. Der Bereich 7,4 bis 6,5 wird in der Praxis als Neutralbereich bezeichnet. Der pH-Wert des Bodens kann durch Kalkgaben auf die gewünschte Höhe eingestellt werden. Der anzustrebende pH-Bereich wird für sandige und stark humose Böden tiefer angesetzt als für tonreiche Böden, da sie weniger kalkbedürftig sind und durch starke Kalkgaben Spurenelementmangel und erhöhter Humusabbau eintreten.[3]
Pufferung
Die Pufferung eines Bodens ist seine Widerstandsfähigkeit gegen pH-Wert Änderungen bei Zufuhr von H+ oder OH−-Ionen. Diese Widerstandsfähigkeit ist deshalb von Bedeutung, weil Pflanzen und Bodenorganismen auf plötzliche Änderungen des Säuregrades sehr empfindlich reagieren. Die Pufferungskapazität eines Bodens wird in erster Linie von der Kationenaustauschkapazität und von der Basensättigung eines Bodens bestimmt. Eine plötzliche Zufuhr von H+-Ionen in der Bodenlösung wird dadurch neutralisiert, dass diese gegen basische Kationen des Sorptionskomplexes ausgetauscht werden. Umgekehrt wird eine plötzliche Zufuhr von OH−-Ionen durch die Abgabe von H+-Ionen an die Bodenlösung im Austausch gegen basische Kationen neutralisiert. Der pH-Wert ändert sich also erst, wenn die Pufferkapazität erschöpft ist. Wegen der viel höheren Menge sorbierter H+-Ionen braucht ein Boden hoher Austauschkapazität (Tonboden) zur Anhebung des pH-Wertes viel größere Kalkmengen als ein sorptionsschwacher Sandboden. Kalkhaltige Böden haben ein sehr großes Pufferungsvermögen gegenüber Säuren.[3]
Untersuchungsmethoden der Bodenchemie
Neue Erkenntnisse über die Chemie von Böden stammen häufig aus Untersuchungen im Labor, bei denen Bodenproben aus ungestörten Bodenhorizonten im Feld in Experimenten verwendet werden, die wiederholte Behandlungen und Kontrollen umfassen. Nach althergebrachter Vorgehensweise werden die Bodenproben bei Umgebungstemperaturen (z. B. 25 °C) luftgetrocknet und vor der Lagerung für weitere Untersuchungen auf eine Größe von 2 mm gesiebt. Ein solches Trocknen und Sieben von Bodenproben stört die Bodenstruktur, die Diversität der mikrobiellen Population und die chemischen Eigenschaften in Bezug auf den pH-Wert, den Oxidations-Reduktions-Status, den Mangan-Oxidationszustand und die gelösten organischen Stoffe deutlich; unter anderen Eigenschaften. Das Erkenntnisinteresse an neuen substantiellen Resultaten hat viele Bodenchemiker in den letzten Jahrzehnten dazu veranlasst, Bodenproben vor und während der Untersuchungen in einem feldfeuchten Zustand zu halten und bei 4 °C unter aeroben Bedingungen zu lagern.
Bei Laboruntersuchungen in der Bodenchemie werden häufig zwei Ansätze verfolgt. Die erste ist als „Batch-Äquilibrierung“ bekannt. Der Chemiker fügt ein bestimmtes Volumen Wasser oder Salzlösung mit bekannter Konzentration gelöster Ionen zu einer Erdmasse hinzu (z. B. 25 ml Lösung zu 5 g Erde in einem Zentrifugenröhrchen oder -kolben). Die Erdsuspension wird dann geschüttelt oder geschwenkt eine vorgegebene Zeitspanne (z. B. 15 Minuten bis viele Stunden), um einen stabilen Zustand oder Gleichgewichtszustand herzustellen, bevor mit hoher Geschwindigkeit filtriert oder zentrifugiert wird, um Sandkörner, Schluffpartikel und Tonkolloide von der äquilibrierten Lösung abzutrennen wird dann unter Verwendung einer von mehreren Methoden analysiert, einschließlich ionenspezifischer Elektroden, Atomabsorptionsspektrophotometrie, Spektrometrie mit induktiv gekoppeltem Plasma, Ionenchromatographie und kolorimetrischen Methoden.In jedem Fall quantifiziert die Analyse die Konzentration oder Aktivität eines Ions oder Moleküls in der Lösungsphase, und durch Multiplizieren der gemessenen Konzentration oder Aktivität (z. B. in mg Ionen/ml) mit dem Verhältnis von Lösung zu Boden (ml Extraktionslösung/g Boden) erhält der Chemiker das Ergebnis in mg Ionen/g Boden. Dieses auf der Masse des Bodens basierende Ergebnis ermöglicht Vergleiche zwischen verschiedenen Böden und Behandlungen. Ein verwandter Ansatz verwendet ein bekanntes Volumen zur Lösung, um die Extraktionslösung durch eine Bodenmenge in kleinen Säulen mit einer kontrollierten Rate auszulaugen (infiltrieren), um zu simulieren, wie Regen, Schneeschmelzwasser und Bewässerungswasser durch Böden auf dem Feld fließen. Das Filtrat wird dann unter Verwendung der gleichen Methoden analysiert, die bei Batch-Äquilibrierungen verwendet werden.
Ein weiterer Ansatz zur Quantifizierung von Bodenprozessen und -phänomenen verwendet "in situ"-Methoden, die den Boden nicht stören, wie dies der Fall ist, wenn der Boden geschüttelt oder mit einer extrahierenden Bodenlösung ausgelaugt wird. Diese Verfahren verwenden gewöhnlich oberflächenspektroskopische Techniken, wie etwa Fourier-Transformations-Infrarotspektroskopie (FTIR), Kernspinresonanz (NMR), Mößbauerspektroskopie und Röntgenspektroskopie. Diese Ansätze zielen darauf ab, Informationen über die chemische Natur der Mineralogie und Chemie von Partikel- und Kolloidoberflächen zu erhalten und darüber, wie Ionen und Moleküle durch Adsorption, Komplexierung und Ausfällung mit solchen Oberflächen assoziiert werden.
Diese Laborexperimente und -analysen haben gegenüber Feldstudien den Vorteil, dass aus den Daten chemische Mechanismen abgeleitet werden können, wie Ionen und Moleküle in Böden reagieren. Man kann Schlussfolgerungen ziehen oder neue Hypothesen über ähnliche Reaktionen in verschiedenen Böden mit unterschiedlichen Texturen, Gehalten an organischen Stoffen, Arten von Tonmineralien und Oxiden, pH-Wert und Entwässerungszustand aufstellen. Laborstudien haben den Nachteil, dass sie einen Teil des Realismus und der Heterogenität von ungestörtem Boden im Feld verlieren, während sie Kontrolle und Extrapolationskraft auf nicht untersuchten Boden gewinnen. Mechanistische Laborstudien in Kombination mit realistischeren, weniger kontrollierten Feldbeobachtungsstudien ergeben oft genaue Annäherungen an das Verhalten und die Chemie der Böden, die räumlich heterogen und zeitlich variabel sein können. Eine weitere Herausforderung für Bodenchemiker besteht darin, wie mikrobielle Populationen und Enzymaktivität in Feldböden verändert werden können, wenn der Boden gestört wird, sowohl im Feld als auch im Labor, insbesondere wenn Bodenproben vor Laboruntersuchungen und -analysen getrocknet werden.
Siehe auch
- Bodenuntersuchung
- Boden-pH
- Pufferbereich (Bodenkunde)
- Hauptnährstoff
- Mikronährstoff, siehe Nährstoff (Pflanze)
- Bodenversalzung
Literatur
- Wolfgang Ziechmann, Ulrich Müller-Wegener: Bodenchemie. Bibliographisches Institut BI-Wissenschafts-Verlag, Mannheim 1990, ISBN 3-411-03205-7.
- Garrison Sposito: The chemistry of soils. 3. Aufl. Oxford University Press, New York [2016], ISBN 978-0-19-063088-1. (Übers. einer
älterenAuflage ins Deutsche: Garrison Sposito: Bodenchemie. Ferdinand Enke Verlag, Stuttgart 1998, ISBN 3-432-29671-1.)
Einzelnachweise
- Herbert Kuntze, Günter Roeschmann, Georg Schwerdtfeger: Bodenkunde. (= UTB; 8076) 5., neu bearb. und erw. Aufl., Eugen Ulmer Verl., Stuttgart 1994, ISBN 3-8252-8076-4, S. 100.
- [Johann Dörfler, Heinrich Hüffmeier (Red.):] Pflanzliche Erzeugung: Grundlagen des Acker- und Pflanzenbaus – Grundlagen des integrierten Landbaus – Produktionstechnik der Kulturpflanzen – Dauergrünland – Nachwachsende Rohstoffe – Ökologischer Landbau – Naturschutz, Landschaftspflege. (= Die Landwirtschaft; 1) 11., völlig neubearb. und erw. Aufl., BLV Verlagsgesellschaft, München 1998, ISBN 3-405-15445-6, Kap. 7.1 „Austauschvorgänge“: S. 48.
- [Johann Dörfler, Heinrich Hüffmeier (Red.):] Pflanzliche Erzeugung: Grundlagen des Acker- und Pflanzenbaus – Grundlagen des integrierten Landbaus – Produktionstechnik der Kulturpflanzen – Dauergrünland – Nachwachsende Rohstoffe – Ökologischer Landbau – Naturschutz, Landschaftspflege. (= Die Landwirtschaft; 1) 11., völlig neubearb. und erw. Aufl., BLV Verlagsgesellschaft, München 1998, ISBN 3-405-15445-6, Kap. 7.2 „pH-Wert, Versauerung, Pufferung“: S. 48–50.