BIA 10-2474
BIA 10-2474 ist ein experimenteller Inhibitor der Fettsäureamid-Hydrolase, der von dem portugiesischen Pharmaunternehmen Bial Portela e C.ª, S.A. entwickelt wurde. Er interagiert mit dem menschlichen Endocannabinoid-System. Der Wirkstoff wurde entwickelt, um Schmerz zu lindern, zur Stimmungsaufhellung, um Angstzustände zu behandeln und um die Bewegungskoordination bei neurodegenerativen Erkrankungen zu verbessern.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
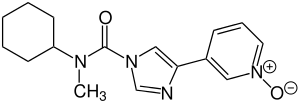 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | BIA 10-2474 | ||||||||||||
| Andere Namen |
3-(1-(Cyclohexyl(methyl)carbamoyl)-1H-imidazol-4-yl)pyridin-1-oxid (IUPAC) | ||||||||||||
| Summenformel | C16H20N4O2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 300,36 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Bei einer klinischen Studie mit dem Wirkstoff kam es am 15. Januar 2016 in Rennes (Frankreich) zu schweren neurologischen Nebenwirkungen mit einem Todesfall.
Laut der französischen Tageszeitung Le Figaro handelt es sich bei BIA 10-2474 um 3-(1-(Cyclohexyl(methyl)carbamoyl)-1H-imidazol-4-yl)pyridin-1-oxid.[2]
Wirkungsweise
Fettsäureamid-Hydrolase (FAAH) ist eine Membran-assoziierte Serin-Hydrolase, die endogene biologisch aktive Fettsäuren, darunter auch die Endocannabinoide Anandamid und Oleamid, abbaut.[3] FAAH ist ein entscheidender Regulator der Signalwirkung von Anandamid in vivo und damit des endogenen Cannabinoid-Systems, das die Schmerzwahrnehmung moduliert. Die Wirkung von FAAH wurde anhand eines Tiermodells, Knockout-Mäusen, denen dieses Enzym fehlt, bewiesen. Die Tiere haben einen 15-fach erhöhten endogenen Anandamid-Level im Gehirn und zeigen u. a. eine reduzierte Schmerzwahrnehmung.[4] Die Signaltransduktion von Anandamid erfolgt durch Aktivierung des Cannabinoid-Rezeptors 1 (CNR1), dem Rezeptor, der auch die Wirkung von Δ9-Tetrahydrocannabinol (THC) aus Cannabis sativa, dem aktiven Bestandteil von Marihuana, vermittelt. CNR1 ist ein G-Protein-gekoppelter Rezeptor, der die intrazelluläre Adenylatcyclase-Aktivität hemmt.[5] Die Entwicklung eines FAAH-Inhibitors ist damit ein attraktives therapeutisches Ziel, auch als Ersatz für Marihuana-basierte Therapien, die eine geringe gesellschaftliche Akzeptanz haben.[6]
Phase-I-Studie
Nach entsprechenden Tests an Zellkulturen und in Tierversuchen beauftragte BIAL 2015 das französische Forschungsinstitut Biotrial in Rennes, eine Phase-1-Studie mit BIA 10-2474 durchzuführen. Ergebnisse früherer Phasen der Medikamentenentwicklung wurden nicht veröffentlicht. Aus Sicherheitsaspekten beginnt man Phase-1-Studien, der ersten Applikation am Menschen, mit geringen Dosierungen, die im Laufe der Studie erhöht werden. Nach Aussagen der französischen Gesundheitsministerin Marisol Touraine wurde das Medikament in der ersten Phase an 90 gesunden Probanden (jungen gesunden Männern) ohne ernste Komplikationen getestet. Zusätzlich erhielten 18 weitere freiwillige Probanden ein Placebo. Um die Verträglichkeit der Substanz zu untersuchen wurde die Substanz jeweils einmal appliziert.
Gesundheitsschäden und Todesfall
Im Januar 2016 wurde eine Testgruppe mit sechs jungen gesunden Männern ausgewählt, der die Testsubstanz an aufeinanderfolgenden Tagen verabreicht werden sollte. Nach einer Voruntersuchung begann die Verabreichung am 7. Januar 2016. Nach Aussagen des Forschungsinstituts wurden erste Symptome am 9. Januar beobachtet und die Medikamentengabe daher am nächsten Tag eingestellt.[7][8] Die sechs Männer wurden ins Universitätsklinikum Rennes eingeliefert. Bei fünf Patienten hatte die Substanz das Zentralnervensystem angegriffen, einer von ihnen erlitt an diesem Tag den Hirntod und verstarb wenige Tage später.[9] Unter den fünf anderen Teilnehmern war einer ohne Symptome.[10] und konnte aus dem Hospital entlassen werden.[11] Bei den drei weiteren Probanden werden dauerhafte Schäden befürchtet.[9]
Nach Aussagen des Klinikums leiden die Patienten unter Blutungen und Nekrosen im Gehirn. Eine Prognose wurde noch nicht öffentlich gemacht. Nach der fehlenden Aufklärung von Seiten des Auftraggebers der Studie veröffentlichte die französische Tageszeitung Le Figaro am 21. Januar 2016 ein englischsprachiges Dokument des Protokolls zur Studie. Das Studienprotokoll erklärt, dass BIA 10-2474 in Fällen eingesetzt werden soll, in denen ein Anstieg des endogenen Arachidonoylethanolamid (Anandamid, AEA) von Vorteil sein kann. Weiterhin wird erwähnt, dass BIA 10-2474 als reversibler, lange wirksamer FAAH-Inhibitor mit Wirkung im zentralen und im peripheren Nervensystem entwickelt wurde.[12]
Das Vorkommen schwerwiegender unerwünschter Ereignisse ist in Phase-1-Studien äußerst selten. Den letzten bekannten Fall mit derart schweren Auswirkungen gab es 2006, als der monoklonale Antikörper TGN1412 bei sechs jungen Männern ein multiples Organversagen hervorrief.
Die französische Generalinspektion für Soziale Angelegenheiten (IGAS), die den Fall untersucht, bestätigte, dass die Studie insgesamt ordnungsgemäß zugelassen worden sei, bemängelte jedoch, dass es in der Durchführung zu verschiedenen Verstößen gekommen sei. So habe das Auftragsforschungsinstitut Biotrial sich nicht genügend über den Gesundheitszustand des ersten eingelieferten Probanden informiert, bevor es den anderen Probanden die nächste Dosis verabreicht hatte. Es habe ferner versäumt, die anderen Probanden über die Ereignisse des Vortages zu informieren, so dass diese nicht über ihre weitere Teilnahme an der Studie entscheiden konnten. Auch hätte wegen der Schwere des Zwischenfalls dieser sofort der Arzneimittelbehörde ANSM gemeldet werden müssen und nicht erst, wie geschehen, vier Tage nach der Einlieferung des ersten Probanden und drei Tage nach Abbruch der Studie. Der abschließende Bericht soll Ende März vorliegen.[13]
Kritik und Auswirkungen
Dass BIAL, aber auch andere Pharmafirmen, in frühen Stadien, hier aber besonders nach dem Zwischenfall, keine Aussagen zur Struktur der Arzneimittelkandidaten machen, wird in Wissenschaftlerkreisen bemängelt.[14] Den neuen Zwischenfall hat die British Pharmacological Society zum Anlass genommen, eine Erklärung zu veröffentlichen, in der sie mehr Transparenz und einen frühen Zugang zu allen Daten in katastrophalen Fällen wie diesem fordert.[15] Sie nennt den Umgang der Luftfahrtindustrie mit Zwischenfällen als Vorbild. Insbesondere werden auch strengere Regeln gefordert, die vorsehen, dass nicht gleich eine ganze Gruppe erhöhten Dosierungen ausgesetzt wird. In der Öffentlichkeit wird kritisiert, dass nicht nur BIAL bei der Aufklärung unkooperativ ist, sondern auch die französischen Behörden helfen, Informationen zurückzuhalten.[16] Als Reaktion auf die Veröffentlichung des Studienprotokolls hat die Royal Statistical Society eine Erklärung veröffentlicht, in der sie fordert, mehr Details zur Studie, insbesondere zur Dosierung, publik zu machen.[17] Gleichzeitig kritisiert sie, dass das Studienprotokoll nahelegt, dass man den als Konsequenz aus dem TGN1412-Zwischenfall 2007 veröffentlichten Empfehlungen nicht gefolgt sei.[18] Im Februar 2016 wurden als Reaktion auf die öffentliche Kritik Details zur Chronologie der Studie, insbesondere zur Dosierung, veröffentlicht.[19] Demnach war die Studiengruppe aus acht Personen die fünfte Kohorte, der BIA 10-2474 an aufeinanderfolgenden Tagen verabreicht wurde. Im Vergleich zur vorherigen Kohorte, bei der es keine Zwischenfälle gab, wurde die Dosis von 20 mg auf 50 mg erhöht. Zwei Probanden erhielten ein Placebo.
Nach Bekanntwerden des Zwischenfalls teilte die Firma Johnson & Johnson mit, dass ihre Tochterfirma Janssen Pharmaceutica zwei Studien unterbrochen habe, die ebenfalls die Wirkung von FAAH-Inhibitoren untersuchten. Nach Aussagen des Firmensprechers wurden bei Patienten mit Angststörungen keine unerwünschten Effekte beobachtet.[20]
Weblinks
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Drame de Rennes : le protocole de l'essai clinique en accusation. In: sante.lefigaro.fr. Abgerufen am 21. Januar 2016.
- Benjamin F. Cravatt, Dan K. Giang, Stephen P. Mayfield, Dale L. Boger, Richard A. Lerner, Norton B. Gilula: Molecular characterization of an enzyme that degrades neuromodulatory fatty-acid amides. In: Nature. 384, Nr. 6604, 1996, S. 83–87. doi:10.1038/384083a0.
- M. H. Bracey: Structural Adaptations in a Membrane Enzyme That Terminates Endocannabinoid Signaling. In: Science. 298, Nr. 5599, 2002, S. 1793–1796. doi:10.1126/science.1076535.
- Hui-Chen Lu, Ken Mackie: An Introduction to the Endogenous Cannabinoid System. In: Biological Psychiatry. 2015. doi:10.1016/j.biopsych.2015.07.028.
- C. J. Fowler: The Potential of Inhibitors of Endocannabinoid Metabolism for Drug Development: A Critical Review. Handbook of Experimental Pharmacology 231, 2015, S. 95–128, PMID 26408159.
- More details emerge on fateful French drug trial, Editorial im Science Magazin (16. Januar 2016).
- Researchers question design of fatal French clinical trial, Editorial in Nature (22. Januar 2016, updated am 23. Januar 2016).
- Spiegel.de: Frankreich: Patient nach Medikamententest für tot erklärt, 18. Januar 2016, abgerufen am 2. Februar 2016.
- What we know so far about clinical trial disaster in France, Editorial im Science Magazin (15. Januar 2016).
- Drugmaker in fatal trial received EU funds.
- News Release – Phase I Clinical Trial Rennes. In: www.bial.com. Archiviert vom Original am 22. Januar 2016. Abgerufen am 25. Januar 2016.
- https://www.deutsche-apotheker-zeitung.de/news/artikel/2016/02/04/gesundheitsministerin-sieht-drei-bedeutende-verstosse-bei-biotrial
- Scientists in the dark after French clinical trial proves fatal, Editorial in Nature (18. Januar 2016).
- 'British Pharmacological Society (22 Januar 2016) Improve early access to data from catastrophic clinical trials: A statement on behalf of the British Pharmacological Society (Memento vom 25. Januar 2016 im Internet Archive).
- sueddeutsche.de: Nun zeigt sich die Kaltblütigkeit der Branche.
- Erklärung der Royal Statistical Society
- Stephen Senn, Dipti Amin, Rosemary A. Bailey, Sheila M. Bird, Barbara Bogacka, Peter Colman, Andrew Garrett, Andrew Grieve, Peter Lachmann: Statistical issues in first-in-man studies. In: Journal of the Royal Statistical Society: Series A (Statistics in Society). 170, Nr. 3, 2007, S. 517–579. doi:10.1111/j.1467-985X.2007.00481.x.
- Studiendetails (Chronologie).
- http://www.reuters.com/article/johnsonjohnson-drugtrial-idUSL2N1552YO.