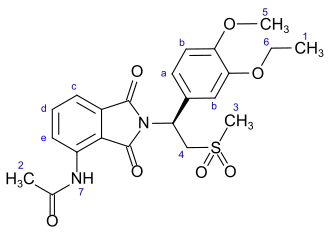
Apremilast
Apremilast (Handelsname: Otezla; Hersteller: Amgen) ist ein Arzneistoff aus der Gruppe der Phosphodiesterase-Hemmer, der in der Behandlung von mittelschwerer bis schwerer chronischer Plaque-Psoriasis und Psoriasisarthritis eingesetzt wird. Der Wirkstoff wurde für diese Indikationen 2014 in den USA und 2015 in Europa zugelassen.[3][4][5]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
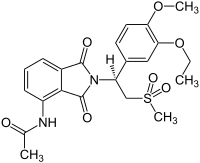 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Apremilast | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C22H24N2O7S | |||||||||||||||||||||
| Kurzbeschreibung |
kristalliner Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L04AA32 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 460,5 g·mol−1 | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Klinische Angaben
Anwendungsgebiete
Apremilast wird bei folgenden Erkrankungen angewendet:
- Psoriasis-Arthritis:[5] Apremilast allein oder in Kombination mit krankheitsmodifizierenden antirheumatischen Arzneimitteln (Basistherapie#Basistherapie bei rheumatischen Erkrankungen|DMARDs) zur Behandlung der aktiven Psoriasis-Arthritis (PsA) bei erwachsenen Patienten, die auf eine vorangegangene DMARD-Therapie unzureichend angesprochen oder diese nicht vertragen haben.
- Psoriasis: [5] Apremilast zur Behandlung der mittelschweren bis schweren chronischen Plaque-Psoriasis bei erwachsenen Patienten, die auf eine andere systemische Therapie, wie Ciclosporin oder Methotrexat oder Psoralen in Kombination mit UVA-Licht (PUVA), nicht angesprochen haben oder bei denen eine solche Therapie kontraindiziert ist oder die diese nicht vertragen haben.
Die Gabe von Apremilast erfolgt normalerweise zweimal täglich (morgens und abends). Um gastrointestinale Beschwerden zu vermeiden, soll die Dosis stufenweise über 6 Tage bis zur endgültigen Dosis gesteigert werden.[5] Das Medikament ist nur für die Behandlung erwachsener Patienten zugelassen.[5]
Gegenanzeigen und Anwendungsbeschränkungen
Apremilast darf nicht gegeben werden bei einer Überempfindlichkeit gegen den Wirkstoff oder wenn eine Schwangerschaft besteht.[5] Vor der Behandlung ist eine Schwangerschaft auszuschließen. Frauen im gebärfähigen Alter müssen eine zuverlässige Verhütungsmethode anwenden, um eine Schwangerschaft zu verhindern.[5] In den USA ist Apremilast der Pregnancy Risk Category (Schwangerschaftskategorie) C der FDA zugeordnet.[6]
Es ist unbekannt, ob der Stoff in die Muttermilch übergeht. Bei Mäusen konnten Metabolite in der Milch nachgewiesen werden.[5] Er soll während der Stillzeit nicht angewendet werden.
Bei Menschen mit Untergewicht vor der Behandlung soll das Körpergewicht regelmäßig kontrolliert werden. Bei auffälligem Gewichtsverlust sollte ein Abbruch der Behandlung erwogen werden.[5]
Bei Personen mit schweren Nierenfunktionsstörungen (Creatinin-Clearance ≤ 30 ml · min−1) ist eine Dosisreduktion vorzunehmen.[5]
Eine sorgfältige Risikoabwägung ist bei Personen nötig, die an Depressionen leiden oder gelitten haben oder von denen bekannt ist, dass sie suizidgefährdet sind.[6]
Wechselwirkungen mit anderen Medikamenten
Starke Induktoren von Cytochrom-P450-Enzymen, z. B. Rifampicin, Phenobarbital oder Phenytoin, führen zu einem verminderten Plasmaspiegel von Apremilast.[5]
Unerwünschte Wirkungen
Als Nebenwirkung häufig auftreten können: Depression, Schlaflosigkeit, Durchfall, Übelkeit, Erbrechen, Infektionen der oberen Atemwege, Rhinopharyngitis und Schmerzen im Oberbauch.[5]
Nicht näher spezifizieren lässt sich das mögliche Auftreten von Überempfindlichkeitsreaktionen, Gewichtsverlust, häufige Stuhlentleerung, Refluxösophagitis, Dyspepsie, verringerter Appetit, Migräne, Husten und Ausschlag.[5]
Pharmakologische Eigenschaften
Wirkungsmechanismus
Apremilast führt durch Hemmung der PDE-4 zu einer Erhöhung des intrazellulären cAMP-Spiegels in Synoviozyten, wodurch es zu einer verminderten Freisetzung von proinflammatorischem TNF-α kommt.[7]
Resorption
Oral genommen besitzt Apremilast eine Bioverfügbarkeit von ca. 73 %. Maximale Plasmaspiegel (Cmax) werden nach ca. 2,5 Stunden erreicht. Die Einnahme zusammen mit einer Mahlzeit beeinflusst die Aufnahme von Apremilast nicht.[5]
Distribution
Die Plasmaproteinbindung beträgt ungefähr 68 %. Das Verteilungsvolumen beläuft sich auf 87 l.[5]
Metabolisierung
Nach der Einnahme findet sich unverändertes Apremilast als Hauptkomponente (45 %) im Blutkreislauf wieder, gefolgt von einem inaktiven Metaboliten, bei dem es sich um ein Glucuronid des O-demethylierten Apremilast handelt. Apremilast wird im Menschen stark metabolisiert und bildet bis zu 23 Metabolite, die im Plasma, im Harn und den Fäkalien nachgewiesen werden können. Der Abbau erfolgt sowohl durch CYP-enzymatische Oxidation und anschließende Glucuronidierung als auch durch Hydrolyse durch andere Enzyme. In vitro zeigte sich, dass Apremilast in erster Linie von CYP3A4 umgesetzt wird und in geringerem Umfang auch von CYP1A2 und CYP2A6.[5]
Elimination
Die Clearance von Apremilast beträgt ca. 10 l/h bei Gesunden. Die Eliminationshalbwertzeit liegt bei 6–9 Stunden. Nach oraler Gabe von radioaktiv markiertem Apremilast konnten 58 % (Harn) bzw. 39 % (Faeces) der radioaktiven Dosis wiedergefunden werden. Dabei waren 3 % (Harn) und 7 % (Faeces) unverändertes Apremilast.[5]
Chemische und pharmazeutische Informationen
Synthese
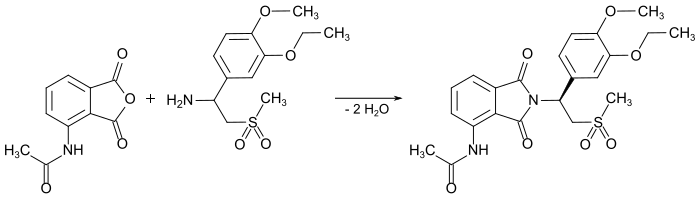
Eine Lösung von gleichen Anteilen an 1-(3-Ethoxy-4-methoxyphenyl)-2-methylsulfonylethylamin und 3-Acetamidophthalsäureanhydrid wird in Essigsäure für 15 h unter Rückfluss erhitzt. Das Produkt entsteht als gelber Feststoff mit einem Schmelzpunkt von 144 °C bei einer Ausbeute von 59 %.[8]
Frühe Nutzenbewertung
In Deutschland müssen seit 2011 neu zugelassene Medikamente mit neuen Wirkstoffen gemäß § 35a SGB V einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterzogen werden, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seine Beschlüsse fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
Bei der frühen Nutzenbewertung wurde Apremilast 2015 für die aktive Psoriasis-Arthritis bei Erwachsenen, die auf eine vorangegangene DMARD-Therapie unzureichend angesprochen oder diese nicht vertragen haben, mit einem TNF-alpha-Hemmer (Etanercept oder Adalimumab oder Infliximab oder Golimumab) ggf. in Kombination mit Methotrexat verglichen. Für Erwachsene mit mittelschwerer bis schwerer chronischer Plaque-Psoriasis, die auf eine andere systemische Therapie wie Ciclosporin oder Methotrexat oder Psoralen in Kombination mit UVA-Licht nicht angesprochen haben oder bei denen eine solche Therapie kontraindiziert ist oder die diese nicht vertragen haben, war Adalimumab oder Infliximab oder Ustekinumab die zweckmäßige Vergleichstherapie.[9] Gemäß G-BA-Beschluss ist ein Zusatznutzen gegenüber diesen zweckmäßigen Vergleichstherapien für keine der beiden Indikationen belegt.[10]
Handelsnamen
Otezla
Sonstiges
Im Rahmen der Verbindung von Celgene mit Bristol-Myers Squibb (Merger) wurde im Juni 2019 bekannt gegeben, dass man Otezla veräußern müsse.[11] Das Medikament machte 2018 über 1,5 Mrd. US-Dollar Umsatz.[12] Man spricht in der Pharmaindustrie von einem Blockbuster (i.e. > 1,0 Mrd. US-Dollar Umsatz).
Einzelnachweise
- Cayman Chemical: Apremilast (608141-41-9), abgerufen am 21. Dezember 2019.
- Daniel Purich: The Inhibitor Index A Desk Reference on Enzyme Inhibitors, Receptor Antagonists, Drugs, Toxins, Poisons, Biologics, and Therapeutic Leads. CRC Press, 2017, ISBN 978-1-351-73067-9, S. 1138 (eingeschränkte Vorschau in der Google-Buchsuche).
- EPAR, der EMA (englisch), abgerufen am 18. Mai 2021.
- Zusammenfassung des EPAR für die Öffentlichkeit, der EMA, abgerufen am 18. Mai 2021.
- Zusammenfassung der Merkmale des Arzneimittels, Europäische Arzneimittelagentur, abgerufen am 14. November 2021.
- Otezla Prescribing Information (PDF) In: Prescribing Information. Celgene Corporation. Abgerufen am 5. Juli 2014.
- AxonMedchem-Eintrag zu Apremilast. axonmedchem.com. Archiviert vom Original am 28. Juli 2014. Abgerufen am 5. Juli 2014.
- Patent US6011050A: Substituted phenethylsulfones and method of reducing TNFα levels. Veröffentlicht am 4. Januar 2000, Erfinder: George W. Muller, Hon-Wah Man.
- A15-09 Apremilast – Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). iqwig.de; abgerufen am 24. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Apremilast (Plaque-Psoriasis, Psoriasis-Arthritis). g-ba.de; abgerufen am 24. März 2020.
- Bristol-Myers Squibb Provides Update on Pending Merger with Celgene. PM BMS, 24. Juni 2019; abgerufen am 12. Juli 2019.
- US-Handelsaufsicht schaut bei Celgene-Übernahme genauer hin, abgerufen am 12. Juli 2019.