Aminomethylphosphonsäure
Aminomethylphosphonsäure (auch Aminomethanphosphonsäure, Aminomethylphosphonic Acid, AMPA) ist das Hauptabbauprodukt des Breitbandherbizids Glyphosat. AMPA wird von der Bodenmikroflora mineralisiert, allerdings mit einer niedrigeren Abbaurate als Glyphosat selbst.[3] In der Umwelt wurde AMPA häufiger und in höheren Konzentrationen als Glyphosat gefunden.[4]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
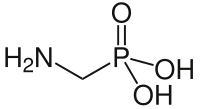 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Aminomethylphosphonsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CH6NO3P | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 111,04 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
286,5 °C (Zers.)[1] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Der Metabolit AMPA entsteht auch als Abbauprodukt von stickstoffhaltigen organischen Phosphonsäuren (Aminopolyphosphonaten), wie ATMP, EDTMP und DTPMP. Da Phosphonate in Waschmitteln, als Inhibitoren gegen Korrosion und Kesselsteinbildung in Kühl- und Kesselspeisewässern, und in der Textil- und Papierindustrie in großen Mengen eingesetzt werden, kann beim Nachweis von AMPA in Gewässern nicht ohne weiteres geklärt werden, auf welche Quelle dies zurückzuführen ist.[5]
Eigenschaften
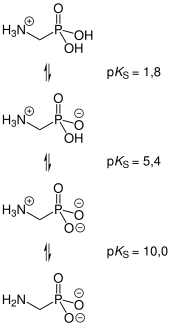
AMPA ist ein Analogon der Aminosäure Glycin, wobei die COOH-Gruppe durch eine PO(OH)2-Gruppe (Phosphonsäure-Gruppe) ersetzt wurde. Im Gegensatz zu den Amino(mono)carbonsäuren sind Phosphonsäuren aber zweibasig; d. h. sie können an Basen zwei Protonen abgeben, z. B. an H2O-Moleküle, wenn sie in Wasser gelöst werden. Da AMPA aber eine Aminogruppe H2N– enthält, die eine stärkere Base ist als H2O, fängt die Aminogruppe 1 Proton ein und wird dadurch zur positiv geladenen Ammonio-Gruppe (H3N+–). So entsteht ein Zwitterion, welches bereits im festen Aggregatzustand vorlegen dürfte. Indiz dafür ist der relativ hohe Schmelz- bzw. Zersetzungspunkt.
Im Prinzip kann die PO(OH)2-Gruppe von AMPA zwei Protonen abgeben, d. h. vollständig dissoziieren. Die Acidität des Zwitterions wird daher durch drei pKa-Werte beschrieben. Man ermittelte pKa1 = 1,8; pKa2 = 5,4 und pKa3 = 10,0.[6] Der isoelektrische Punkt liegt bei pH 3,45.[7]
Synthese
Über Synthesen der Verbindung wurde schon berichtet, bevor diese als Metabolit von Glyphosat erkannt wurde. Eine Herstellung aus einfachen Edukten war schwierig; es musste mit Schutzgruppen gearbeitet werden. Beispielsweise synthetisierten Kabachnik und Melved die Verbindung aus Phosphonsäure-diethylester (Diethylphosphit), Ammoniak und Formaldehyd (die Reaktion ist als Spezialfall der später so benannten Kabachnik-Fields-Reaktion zu betrachten). Anschließend wurde der gebildete Aminomethanphosphonsäureester hydrolysiert.[8] Die oft für die Herstellung von alpha-Aminomethylphosphonsäuren verwendete Reaktion von Phosphonsäure, Formaldehyd und Ammoniak führte in diesem Fall nicht zum Ziel.[9]
Weblinks
- Joint Meeting on Pesticide Residues (JMPR), Monograph für Aminomethylphosphonic Acid (AMPA)
Einzelnachweise
- James R. Chambers und A. F. Isbell. The Journal of Organic Chemistry, Bd. 29 (1964), 832–836.
- Datenblatt (Aminomethyl)phosphonic acid, 99 % bei Sigma-Aldrich, abgerufen am 21. Oktober 2011 (PDF).
- J. Schuette: Environmental Fate of Glyphosate, 1998, Department of Pesticide Regulation, Sacramento (PDF).
- E. A. Scribner, W. A. Battaglin, R. J. Gilliom, M. T. Meyer: Concentrations of Glyphosate, Its Degradation Product, Aminomethylphosphonic Acid, and Glufosinate in Ground- and Surface-Water, Rainfall, and Soil Samples Collected in the United States, 2001–06, United States Geological Survey Scientific Investigations Report 2007–5122 (PDF).
- Drucksache 17/7168 des Deutschen Bundestages (PDF; 3,6 MB), Antwort der Bundesregierung auf die Kleine Anfrage „Risikobewertung und Zulassung des Herbizid-Wirkstoffs Glyphosat“ (Frage 19), 27. September 2011.
- Zuliang Chen, Wenxiang He, Michael Beer, Mallavaranpu Megharaj, Ravendra Naidu: Speciation of glyphosate, phosphate and aminomethylphosphonic acid in soil extracts by ion chromatography with inductively coupled plasma mass spectrometry with an octopole reaction system. In: Talanta. Band 78, Heft 3, 2009, ISSN 0039-9140, S. 852–856, doi:10.1016/j.talanta.2008.12.052.
- James R. Chambers, A. F. Isbell: The Journal of Organic Chemistry. Band 29, 1964, S. 832–836.
- Martin I. Kabachnik, T. Ya. Melved: Новый метод синтеза сс-аминофосфиновых кислот (A new method for the synthesis of α-amino phosphonic acids). In: Doklady Akademii Nauk SSSR. Band 83, 1952, S. 689.
- Kurt Moedritzer, Riyad R. Irani: The Direct Synthesis of alpha-Aminomethylphosphonic Acids. Mannich-Type Reactions with Orthophosphorous Acid. In: The Journal of Organic Chemistry. Band 31, 1966, S. 1603–1607.
