Acyl-CoA-Dehydrogenase
Acyl-Coenzym A-Dehydrogenasen sind eine Gruppe von mitochondrialen Enzymen, die im ersten Schritt der β-Oxidation die Dehydrierung von Acyl-CoA katalysieren.
| Acyl-CoA-Dehydrogenase | ||
|---|---|---|
| ||
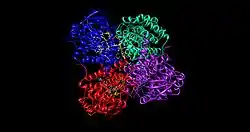
| Quartärstruktur der mittelkettenspezifischen Acyl-CoA-Dehydrogenase (MCAD) | ||
| Andere Namen |
ACAD | |
| Sekundär- bis Quartärstruktur | Homotetramer (LCAD, MCAD, SCAD)
Homodimer (VLCAD, ACAD-9) | |
| Kofaktor | FAD | |
| Isoformen | VLCAD, LCAD, MCAD, SCAD, ACAD-9 | |
| Enzymklassifikation | ||
| EC, Kategorie | 1.3.99.3 | |
| Reaktionsart | Dehydrierung | |
| Substrat | Acyl-CoA | |
| Produkte | trans-Δ2-Enoyl-CoA | |
Katalysierte Reaktion
Acyl-CoA-Dehydrogenase katalysiert den ersten Reaktionsschritt der vierteiligen β-Oxidation. Durch Dehydrierung von Acyl-CoA am zweiten und dritten Kohlenstoffatom (Cα und Cβ) entsteht das Produkt trans-Δ2-Enoyl-CoA. Als Wasserstoffakzeptor und Oxidationsmittel dient die prosthetische Gruppe Flavin-Adenin-Dinukleotid (FAD), welche zu FADH2 reduziert wird.
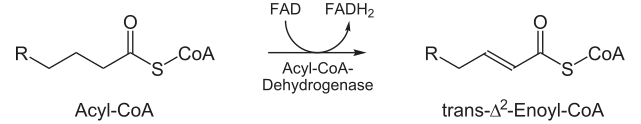
Anstelle des Coenzyms NAD+, das in vielerlei Stoffwechselreaktion auftritt, wird FAD als Oxidationsmittel eingesetzt, da der ΔG-Wert dieser Reaktion nicht ausreicht, um NAD+ zu reduzieren.
Die bei der Oxidation übertragenen Elektronen werden von FADH2 auf das elektronentransferierende Flavoprotein (ETF) und darauffolgend auf das Enzym ETF:Ubichinon-Oxidoreduktase übertragen, welches Ubichinon reduziert. Vom reduzierten Ubichinon ausgehend werden die Elektronen schließlich in die Atmungskette eingespeist.[1]
Isoformen der Acyl-CoA-Dehydrogenase

In jedem Zyklus der β-Oxidation werden sukzessiv C2-Einheiten von Acyl-CoA abgespalten, bis Acetyl-CoA entsteht. Folglich können sich Acyl-CoA-Moleküle bei einer unterschiedlichen Anzahl an durchlaufenen Zyklen der β-Oxidation hinsichtlich ihrer Kettenlänge unterscheiden. Aus diesem Grund sind mehrere Isoformen der Acyl-CoA-Dehydrogenase nötig, um das in seiner Kettenlänge variierende Substrat umzusetzen.[1] Man unterscheidet zwischen Isoformen für kurzkettige (SCAD), mittelkettige (MCAD), langkettige (LCAD) oder sehr langkettige (VLCAD) Acylreste.
Ferner existiert die Isoform ACAD-9, welche für langkettige Acyl-CoA-Moleküle mit ungesättigtem oder gesättigtem Acylrest spezifisch ist. Aufgrund großer struktureller Ähnlichkeiten wird VLCAD als evolutionärer Vorläufer der ACAD-9 angenommen. Beide Isoformen sind zu 47 % in ihrer Aminosäuresequenz identisch und besitzen eine 180 Aminosäurereste lange Sequenz am C-Terminus, welche bei SCAD, MCAD und LCAD nicht vorhanden ist.[2]
| Isoform | Acyl-CoA-Spezifität |
|---|---|
| Very-Long-Chain-Acyl-CoA-Dehydrogenase (VLCAD) | gesättigter Acylrest aus 12–24 C-Atomen[3] |
| Long-Chain-Acyl-CoA-Dehydrogenase (LCAD) | gesättigter Acylrest aus 12–18 C-Atomen[1] |
| Medium-Chain-Acyl-CoA-Dehydrogenase (MCAD) | gesättigter Acylrest aus 4–14 C-Atomen[1] |
| Short-Chain-Acyl-CoA-Dehydrogenase (SCAD) | gesättigter Acylrest aus 4–6 C-Atomen[1] |
| Acyl-CoA-Dehydrogenase-9 (ACAD-9) | gesättigter/ungesättigter Acylrest aus 14–20 C-Atomen[2][4] |
SCAD, MCAD, LCAD und VLCAD weisen bei Acylresten aus 4, 8, 14 bzw. 16 C-Atomen die höchste Enzymaktivität auf. ACAD-9 besitzt bei ungesättigten langkettigen Acylresten die höchste katalytische Aktivität.[5]
Struktur und Lokalisation
Die langketten-, mittelketten- und kurzkettenspezifischen Isoformen LCAD, MCAD und SCAD besitzen eine homotetramere Quartärstruktur und sind im mitochondrialen Matrixraum lokalisiert. Die Proteinuntereinheiten besitzen eine Masse von ca. 45 kDa.
Im Unterschied hierzu sind die etwa 70 kDa schweren Proteinuntereinheiten der VLCAD und ACAD-9 in einem Homodimer organisiert, das an die innere Mitochondrienmembran assoziiert ist.[2]
Jede Proteinuntereinheit der Acyl-CoA-Dehydrogenasen enthält eine FAD-haltige katalytische Domäne, die über elektrostatische Wechselwirkungen mit je einem ETF in Kontakt steht.[6]
Defekte der Acyl-CoA-Dehydrogenase
Defekte der Acyl-CoA-Dehydrogenase sind ursächlich für zahlreiche hereditäre Stoffwechselerkrankungen, wie:
- MCAD-Mangel
- VLCAD-Mangel
- SCAD-Mangel
Es sind keine durch LCAD- oder ACAD-9-Mangel hervorgerufenen Störungen des Fettsäurestoffwechsels bekannt.[2] ACAD-9 Defekte stehen jedoch in Verbindung mit einem Mangel an Komplex I.[7]
Literatur
- Lubert Stryer: Biochemie. 7. Auflage. Springer-Verlag, Berlin Heidelberg 2013, ISBN 978-3-8274-2988-9.
- Peter C. Heinrich, Matthias Müller, Lutz Graeve: Biochemie und Pathobiochemie. 9. Auflage. Springer-Verlag, Berlin Heidelberg 2014, ISBN 978-3-642-17971-6
Einzelnachweise
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 7. Auflage. Springer-Verlag, Berlin Heidelberg 2013, ISBN 978-3-8274-2988-9, S. 653–654.
- Regina Ensenauer, Miao He, Jan-Marie Willard, Eric S. Goetzman, Thomas J. Corydon, Brian B. Vandahl, Al Walid Mohsen, Grazia Isaya, Jerry Vockley: Human Acyl-CoA Dehydrogenase-9 Plays a Novel Role in the Mitochondrial β-Oxidation of Unsaturated Fatty Acids. In: Journal of Biological Chemistry. September 2005, abgerufen am 19. September 2021 (englisch).
- Peter C. Heinrich, Matthias Müller, Lutz Graeve: Biochemie und Pathobiochemie. 9. Auflage. Springer-Verlag, Berlin Heidelberg 2014, ISBN 978-3-642-17971-6, S. 265.
- Ada Hamosh: Acyl-CoA Dehydrogenase family, Member 9; ACAD9. In: Online Mendelian Inheritance in Man. 2016, abgerufen am 20. September 2021 (englisch).
- Rebecca L. Fagan, Bruce A. Palfey: 7.03.3.2 Acyl-CoA Dehydrogenases and Oxidases. In: ScienceDirect. 2010, abgerufen am 19. September 2021 (englisch).
- Jung-Ja P. KIM, Ming Wang, Rosemary Paschke: Crystal structures of medium-chain acyl-CoA dehydrogenase from pig liver mitochondria with and without substrate. 1993, abgerufen am 12. September 2021 (englisch).
- Jessica Nouws, Leo Nijtmans, Sander M. Houten, Mariël van den Brand, Martijn Huynen, Hanka Venselaar, Saskia Hoefs, Jolein Gloerich, Jonathan Kronick, Timothy Hutchin, Peter Willems, Richard Rodenburg, Ronald Wanders, Lambert van den Heuvel, Jan Smeitink, Rutger O. Vogel: Acyl-CoA Dehydrogenase 9 Is Required for the Biogenesis of Oxidative Phosphorylation Complex I. In: ScienceDirect. 8. September 2010, abgerufen am 25. September 2021 (englisch).