Mitochondrielle NADH-Dehydrogenase
Das Enzym NADH-Dehydrogenase (Nicotinamidadenindinukleotid-Dehydrogenase), genauer NADH : Coenzym Q Oxidoreduktase (systematischer Name), auch Komplex I der mitochondrialen Atmungskette genannt, ist eine Oxidoreduktase. Das Enzym katalysiert in einer gekoppelten Reaktion die Oxidation von NADH mit der Reduktion von Coenzym Q und verbindet dies mit der Translokation von Protonen aus dem Matrixraum (innen) in den Intermembranraum (außen) des Mitochondriums:
- NADH + Ubichinon + 5 H+innen → NAD+ + Ubichinol + 4 H+außen
| Mitochondrielle NADH-Dehydrogenase | ||
|---|---|---|
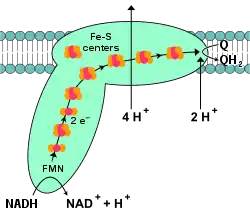 | ||
| Schematische Darstellung von Komplex I in der inneren Mitochondrienmembran | ||
| Masse/Länge Primärstruktur | ca. 1000 kDa | |
| Bezeichner | ||
| Gen-Name(n) | NDH | |
| Transporter-Klassifikation | ||
| TCDB | 3.D.1 | |
| Bezeichnung | Protonentranslozierende NADH-Dehydrogenase | |
| Enzymklassifikation | ||
| EC, Kategorie | 1.6.5.3, Oxidoreduktase | |
| Reaktionsart | Redoxreaktion | |
| Substrat | NADH + Ubichinon | |
| Produkte | NAD+ + Ubichinol | |
Mechanismus
Die Redoxreaktionen finden alle im hydrophilen, peripheren Arm des Komplexes statt, der in die Mitochondrienmatrix hineinragt. NADH bindet an der Spitze dieses Arms in der Nukleotidbindestelle und gibt zwei Elektronen an den Kofaktor FMN ab und wird dadurch zu NAD+ oxidiert. Die Elektronen durchlaufen dann die Elektronentransportkette, deren Zentren allerdings jeweils nur ein Elektron aufnehmen, so dass die Elektronen nun aufgeteilt werden: eins wird auf das Eisen-Schwefel-Zentrum N1a übertragen, das andere auf das Eisen-Schwefel-Zentrum N3 und von dort aus weiter über N1b, N4, N5, N6a, und N6b auf das Eisen-Schwefel-Zentrum N2. Von diesem letzten Zentrum der Elektronentransportkette wird das Elektron auf das zweite Substrat Ubichinon übertragen, das zusammen mit dem zweiten Elektron, das dann ebenfalls denselben Weg geht, zu Ubichinol reduziert wird. Die einzige funktionelle Bindestelle für Ubichinon befindet sich an der Kontaktstelle des hydrophilen und hydrophoben Teils.
Der (hydrophobe) Membranarm des Komplexes besteht unter anderem aus drei Antiporter-ähnlichen Untereinheiten, von denen vermutet wird, dass sie in die Translokation von Protonen involviert sind. Der genaue Mechanismus der Translokation ist jedoch noch nicht geklärt. Bei den letzten beiden Schritten der Elektronentransportkette, bei der Übertragung der Elektronen auf N2 und auf Ubichinon, wird der größte Teil der Energie frei, so dass von hier auf noch unbekannte Art die Energie auf die Antiporter-ähnlichen Untereinheiten übertragen wird.
Inhibitoren
Rotenon und Piericidin A sind zwei Inhibitoren, die strukturelle Ähnlichkeit zu Ubichinon aufweisen und die Ubichinonbindestelle blockieren, der Elektronentransfer wird somit unterbrochen. Weitere Inhibitoren sind Amytal und Asimicin. Ein NADH-analoger Inhibitor, der die Nukleotidbindestelle blockiert, ist Adenosindiphosphatribose. Neue Untersuchungen zeigen, dass das orale Antidiabetikum Metformin aus der Gruppe der Biguanide ein schwacher, aber selektiver Inhibitor des Komplex 1 in menschlichen Hepatozyten darstellt. Dies führt zu einem Anstieg des zellulären AMP/ATP-Quotienten, was eine Aktivierung der AMP-abhängigen Kinase zur Folge hat. Diese Aktivierung der AMPK hat vielfältige Auswirkungen auf den Kohlenhydrat- und Lipidstoffwechsel.
In Pflanzen hat sich als Alternativenzym die NAD(P)H-Dehydrogenase gebildet, die Rotenon-insensitiv ist.
Siehe auch
Weitere Enzym-Komplexe der mitochondrialen Atmungskette:
- Komplex II auch Succinat-Dehydrogenase
- Komplex III auch Cytochrom-c-Reduktase
- Komplex IV auch Cytochrom-c-Oxidase
- Komplex V auch ATP-Synthase
Literatur
- Sazanov, L.A. & Hinchliffe, P. (2006): Structure of the hydrophilic domain of respiratory complex I from Thermus thermophilus. In: Science. Bd. 311, S. 1430–1436. PMID 16469879
- Brandt, U. (2006): Energy converting NADH:quinone oxidoreductase (complex I). In: Annu. Rev. Biochem. Bd. 75, S. 69–92. PMID 16756485.
- Flemming, D. & Friedrich, T. (2005): Die modulare Evolution eines Enzymkomplexes (PDF; 397 kB). In: Bioforum. Jg. 2005, Nr. 6.
Weblinks
- Complex I Homepage
- Complex I (Memento vom 30. August 2005 im Internet Archive)
- Complex I