3-(N-Morpholino)propansulfonsäure
3-(N-Morpholino)propansulfonsäure (MOPS) ist eine biochemische Puffersubstanz aus der Gruppe der Morpholine.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
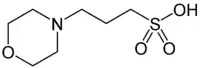 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 3-(N-Morpholino)propansulfonsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C7H15NO4S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 209,3 g·mol−1[2] | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Schmelzpunkt |
283,5 – 284,5 °C[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Eigenschaften
MOPS ist ein zwitterionischer Good-Puffer mit einem pKa-Wert von 7,2 (mit ΔpKa/°C = −0,013[3] bis −0,015[2]), weshalb er sich zur Pufferung bei neutralen pH-Werten eignet.[4] Wie alle Good-Puffer wurde MOPS entwickelt, um möglichst wenige Wechselwirkungen mit Proteinen, eine hohe Löslichkeit, keine Diffusion durch Biomembranen, einen Pufferbereich zwischen pH 6 und 8, eine geringe Toxizität, eine geringe UV-Absorption, eine Unabhängigkeit der Pufferwirkung von anderen Faktoren, eine kostengünstige Herstellung und eine metabolische und chemische Stabilität aufzuweisen. MOPS neigt nur wenig zur Komplexierung von Metallionen,[5] wie auch 2-(N-Morpholino)ethansulfonsäure (MES) und 2,2'-(1,4-Piperazindiyl)diethansulfonsäure (PIPES). MES ist eine strukturell mit MOPS verwandte Puffersubstanz, die wiederum mit HEPES strukturell verwandt ist. MOPS kann die Thermostabilität von bovinem Serumalbumin in Lösungen erhöhen.[6] Peroxinitrit setzt nach Reaktion mit MOPS Stickoxid frei.[7] MOPS zerfällt teilweise, wenn es in Anwesenheit von Glucose autoklaviert wird.[8]
Anwendung
MOPS wird bei der Proteinreinigung verwendet, z. B. bei der Chromatographie,[9] bei Agarose-Gelelektrophoresen[10] und bei Polyacrylamid-Gelelektrophoresen wie die kationische PAGE[11] und die SDS-PAGE. In der Zellkultur von Säugetierzellen wird MOPS in einer Konzentration unter 20 mM als nicht-toxische Puffersubstanz verwendet.[12] Bei der bakteriellen Zellkultur wird die metabolische Ansäuerung des Zellkulturmediums durch Zugabe von MOPS verlangsamt.[13] MOPS kann im Zuge einer PCR-Optimierung dem PCR-Puffer zugesetzt werden.[14]
Literatur
- L. N. Roy, R. N. Roy, K. A. Allen, C. J. Mehrhoff, I. B. Henson, J. M. Stegner: Buffer standards for the physiological pH of the zwitterionic compound of 3-(N-morpholino)propanesulfonic acid (MOPS) from T = (278.15 to 328.15) K. In: The Journal of chemical thermodynamics. Band 47, April 2012, S. 21–27, doi:10.1016/j.jct.2011.09.010. PMID 22247568. PMC 3254115 (freier Volltext).
Einzelnachweise
- Eintrag zu MORPHOLINOPROPANE SULFONIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 3. Juli 2020.
- Datenblatt MOPS, BioPerformance Certified, cell culture tested, ≥99.5% (titration) bei Sigma-Aldrich, abgerufen am 19. Dezember 2014 (PDF).
- R. Goldberg, Kishore, N.; Lennen, R.: Thermodynamic Quantities for the Ionization Reactions of Buffers. In: J. Phys. Chem. Ref. Data. 31, Nr. 2, 2002, S. 231–370. doi:10.1063/1.1416902.
- N. E. Good, G. D. Winget, W. Winter, T. N. Connolly, S. Izawa, R. M. Singh: Hydrogen ion buffers for biological research. In: Biochemistry. Band 5, Nummer 2, Februar 1966, S. 467–477, PMID 5942950.
- C. Montigny, P. Champeil: Use of metallochromic dyes and potentiometric pH-meter titration to detect binding of divalent cations to "Good's" buffers: 4-morpholinepropanesulfonic acid (Mops) does not bind Mg2+. In: Analytical Biochemistry. Band 366, Nummer 1, Juli 2007, S. 96–98, doi:10.1016/j.ab.2007.02.025. PMID 17407760.
- B. S. Gupta, M. Taha, M. J. Lee: Buffers more than buffering agent: introducing a new class of stabilizers for the protein BSA. In: Physical chemistry chemical physics : PCCP. Band 17, Nummer 2, Januar 2015, S. 1114–1133, doi:10.1039/c4cp04663c. PMID 25415385.
- K. Schmidt, S. Pfeiffer, B. Mayer: Reaction of peroxynitrite with HEPES or MOPS results in the formation of nitric oxide donors. In: Free Radical Biology and Medicine. Band 24, Nummer 5, März 1998, S. 859–862, PMID 9586817.
- The Merck Index, 12. Auflage, Entry# 6346.
- C. R. Narahari, J. C. Strong, D. D. Frey: Displacement chromatography of proteins using a self-sharpening pH front formed by adsorbed buffering species as the displacer. In: Journal of Chromatography A. Band 825, Nummer 2, November 1998, S. 115–126, PMID 9842719.
- J. Sambrook, T. Maniatis, D. W. Russel: Molecular cloning: a laboratory manual. 3rd edition (2001), Cold Spring Harbor Laboratory Press. ISBN 0-87969-577-3.
- J. M. Thomas, M. E. Hodes: A new discontinuous buffer system for the electrophoresis of cationic proteins at near-neutral pH. In: Analytical biochemistry. Band 118, Nummer 1, November 1981, S. 194–196, PMID 6278979.
- Harry Eagle: Buffer combinations for mammalian cell culture. In: Science. Band 174, Nummer 4008, Oktober 1971, S. 500–503, PMID 5110427.
- G. A. Somkuti, S. E. Gilbreth: Influence of organic buffers on bacteriocin production by Streptococcus thermophilus ST110. In: Current microbiology. Band 55, Nummer 2, August 2007, S. 173–177, doi:10.1007/s00284-007-0179-x. PMID 17632754.
- A. Ahmad, J. Ghasemi: New buffers to improve the quantitative real-time polymerase chain reaction. In: Bioscience, Biotechnology, and Biochemistry. Band 71, Nummer 8, August 2007, S. 1970–1978, doi:10.1271/bbb.70164. PMID 17690445.
