3,4-Methylendioxy-N-ethylamphetamin
3,4-Methylendioxy-N-ethylamphetamin (kurz MDEA oder MDE) ist eine synthetische Droge mit sehr enger molekular-struktureller Verwandtschaft mit MDMA und MDA. Es zählt strukturell zu den Amphetaminen und ist chiral, d. h., es gibt zwei enantiomere Formen (R)-MDE und (S)-MDE.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
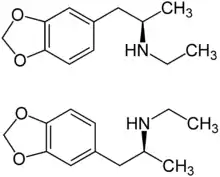 | ||||||||||||||||||||||
| (R)-Form (oben) und (S)-Form (unten) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 3,4-Methylendioxy-N-ethylamphetamin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C12H17NO2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 207,22 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Synthese
Es lässt sich herstellen aus MDA durch Acetylierung und anschließender Reduktion mit Lithiumaluminiumhydrid, oder aus dem entsprechenden Phenylaceton durch Kondensation mit Ethylamin und nachfolgender Reduktion.
Chemische und pharmakologische Eigenschaften
MDE ist chiral. Es gibt zwei enantiomere Formen, die (R)-Form und die dazu spiegelbildliche (S)-Form. Die freie Base MDE ist ein Öl und enthält die funktionelle Gruppe eines sekundären Amins R2NH Die freie Base bildet mit Salzsäure ein kristallines Hydrochlorid R2NH·HCl. MDE blockiert die Aufnahme von den Katecholaminen (Dopamin, Noradrenalin, Adrenalin). Die wirksame Dosierung liegt im Bereich von 100 bis 200 mg, die Wirkdauer liegt im Bereich von drei bis sechs Stunden.
Die Wirkung von MDE auf die Sinneswahrnehmung ähnelt jener von MDMA, ist mit zwei bis drei Stunden jedoch kürzer. MDE wirkt in erster Linie stark entaktogen[4] und schwach empathogen und somit eher in autistischer Richtung und fördert die Ich-Bezogenheit sowie den Verlust sozialer Kontakte.
Rechtslage
MDE erschien kurz nach dem Verbot von MDMA vermehrt als Ersatzstoff auf dem Schwarzmarkt, weshalb es mit 13 weiteren Stoffen mit der 3. BtMÄndV vom 28. Februar 1991[5] mit Wirkung vom 15. April 1991 in Anlage 1 zu § 1 BtMG[6] aufgenommen und jeglicher Umgang (mit Ausnahme des Konsums) mit dieser Substanz verboten ist.
Angepasst an die WHO-Nomenklatur lautet die behördliche Schreibweise seit 1998 Methylendioxyethylamfetamin (f statt ph).
Zusätzliche Informationen
MDE kann ein Bestandteil von Ecstasytabletten sein, bei denen die eigentliche Wirkstoffzusammensetzung meist nur dem Hersteller bekannt ist.
Einzelnachweise
- Externe Identifikatoren von bzw. Datenbank-Links zu Methylenedioxyethamphetamin Hydrochlorid: CAS-Nummer: 74341-78-9, EG-Nummer: 690-036-9, ECHA-InfoCard: 100.217.131, PubChem: 3057998, ChemSpider: 2319186, Wikidata: Q27277667.
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 996, ISBN 978-0-911910-00-1.
- Datenblatt (±)-3,4-Methylenedioxy-N-ethylamphetamine hydrochloride bei Sigma-Aldrich, abgerufen am 20. März 2011 (PDF).
- E. Gouzoulis-Mayfrank, M. Schreckenberger, O. Sabri, C. Arning, B. Thelen, M. Spitzer, K. A. Kovar, L. Hermle, U. Büll, H. Sass: Neurometabolic effects of psilocybin, 3,4-methylenedioxyethylamphetamine (MDE) and d-methamphetamine in healthy volunteers. A double-blind, placebo-controlled PET study with [18F]FDG. In: Neuropsychopharmacology. Band 20, Nummer 6, Juni 1999, S. 565–581, doi:10.1016/S0893-133X(98)00089-X, PMID 10327426.
- Dritte Betäubungsmittelrechts – Änderungsverordnung vom 28. Februar 1991.
- Betäubungsmittelgesetz (BtMG), Stand: 18. Dezember 2009, gültig ab 22. Januar 2010.
Weblinks
- MDE. In: Erowid. (englisch)
- MDE bei PIHKAL
