2-Iodbutan
2-Iodbutan ist eine chemische Verbindung aus der Gruppe der aliphatischen, gesättigten organischen Halogenkohlenwasserstoffe.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
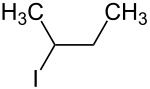 | |||||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Iodbutan | ||||||||||||||||||
| Andere Namen |
sec-Butyliodid | ||||||||||||||||||
| Summenformel | C4H9I | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit etherischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 184,02 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,59 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
118 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,499 (20 °C)1,4991 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Isomere
2-Iodbutan tritt in zwei stereoisomeren Formen, (S)-2-Iodbutan und (R)-2-Iodbutan, auf.
| Isomere von 2-Iodbutan | ||
| Name | (S)-2-Iodbutan | (R)-2-Iodbutan |
| Andere Namen | (+)-2-Iodbutan | (−)-2-Iodbutan |
| Strukturformel | -2-Iodo_butane_Structural_Formula_V.1.svg.png.webp) |
-2-Iodo_butane_Structural_Formula_V.1.svg.png.webp) |
| CAS-Nummer | 29882-56-2 | 22156-92-9 |
| 513-48-4 (unspez.) | ||
| EG-Nummer | – | – |
| 208-163-1 (unspez.) | ||
| ECHA-Infocard | – | – |
| 100.007.422 (unspez.) | ||
| PubChem | 12475337 | 12475336 |
| 10559 (unspez.) | ||
| Wikidata | Q27236239 | Q27277859 |
| Q27258588 (unspez.) | ||
Gewinnung und Darstellung
2-Iodbutan kann durch Reaktion von 2-Brombutan mit Iod gewonnen werden,[3] eine weitere Möglichkeit ist die Finkelstein-Reaktion von Natriumiodid mit 2-Brombutan.
Bei der Reaktion von (R)-2-Brombutan mit Natriumiodid in Aceton entsteht (S)-2-Iodbutan. Wenn als Ausgangsprodukt das Racemat von 2-Brombutan verwendet wird, dann entsteht racemisches 2-Iodbutan.[4]
Ebenfalls möglich ist die Darstellung durch eine Additions-Reaktion von Iodwasserstoff an 1-Buten.[5]
Eigenschaften
2-Iodbutan ist eine leicht entzündbare, leicht flüchtige, farblose Flüssigkeit mit etherischem Geruch, die praktisch unlöslich in Wasser ist.[1]
Verwendung
2-Iodbutan wird als Lösungsmittel bei organischen Synthesen und als Zwischenprodukt für Pharmazeutika verwendet.[2]
Sicherheitshinweise
Die Dämpfe von 2-Iodbutan können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 21 °C) bilden.[1]
Einzelnachweise
- Eintrag zu 2-Iodbutan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. Januar 2019. (JavaScript erforderlich)
- Datenblatt 2-Iodobutane, 99 %, stab. with copper bei AlfaAesar, abgerufen am 27. Januar 2019 (PDF) (JavaScript erforderlich).
- Kurt Peter C. Vollhardt, Neil Eric Schore: Organische Chemie. John Wiley & Sons, 2011, ISBN 3-527-32754-1, S. 241 (eingeschränkte Vorschau in der Google-Buchsuche).
- Alyn William Johnson: Invitation to Organic Chemistry. Jones & Bartlett Learning, 1999, ISBN 978-0-7637-0432-2, S. 93 (eingeschränkte Vorschau in der Google-Buchsuche).
- Henry Rakoff, Norman C. Rose: Organic chemistry. Macmillan, 1966, S. 98 (eingeschränkte Vorschau in der Google-Buchsuche).

