2-Aminothiazol
2-Aminothiazol ist eine chemische Verbindung aus der Gruppe der 1,3-Thiazole und eine primäre Aminoverbindung.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
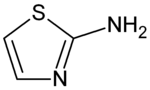 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Aminothiazol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H4N2S | ||||||||||||||||||
| Kurzbeschreibung |
brauner geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 100,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
117 °C (15 mmHg)[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser (100 g/l bei 20 °C), Ethanol und Diethylether[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
2-Aminothiazol kann durch Reaktion von Reaktion von Chloracetaldehyd mit Thioharnstoff oder besser aus Vinylacetat und Thioharnstoff in Gegenwart von Sulfurylchlorid gewonnen werden.[2]
Eigenschaften
2-Aminothiazol ist ein brauner geruchloser Feststoff, der löslich in Wasser, Ethanol und Ether ist.[1] Sie kann in zwei tautomeren Formen vorliegen: Amino und Imino.[3]
Es lässt sich in einer konzentrierten Lösung von Salpeter- und Phosphorsäure leicht diazotieren[4] und kuppelt mit Diazoniumsalzen zu Azofarbstoffen.[2] 2-Aminothiazol reagiert mit Diazaiminiumperchloraten unter Bildung von 1,3,5-Triaziniumperchloraten und reagiert mit Hetarylnitrosoverbindungen unter Bildung der entsprechenden Azoverbindungen. Es kann auch als geeignetes Nukleophil in Mitsunobu-Reaktionen wirken, wenn der exocyclische Stickstoff als Carbamat geschützt ist.[4]
Verwendung
2-Aminothiazol wird bei der Synthese von mit 2-Aminothiazol modifiziertem Kieselgel und bei der Ullmann-Kupplung mit 2-Chlorbenzoesäuren durch Ultraschallbestrahlung verwendet. Es wirkt als Bestandteil von Dispersionsfarbstoffen, als Schilddrüsenhemmer bei der Behandlung von Schilddrüsenüberfunktion, als Säuretartrat und als Therapeutikum bei Prionen-Erkrankungen. Es wird auch zur Abtötung von Bakterien verwendet.[1] Es dient auch als Ausgangsprodukt zur Synthese des Sulfonamids Sulfathiazol.[2] Derivate von 2-Aminothiazol sind potente Inhibitoren der Cyclin-abhängigen Kinase 5 und werden als Therapeutika zur Behandlung der Alzheimer-Krankheit und anderer neurodegenerativer Erkrankungen untersucht.[5]
Einzelnachweise
- Datenblatt 2-Aminothiazole, 97% bei AlfaAesar, abgerufen am 23. Februar 2022 (PDF) (JavaScript erforderlich).
- Lexikon der Chemie: 2-Aminothiazol, abgerufen am 23. Februar 2022
- Yi Zeng, Yi Ren: Density functional theory study of tautomerization of 2-aminothiazole in the gas phase and in solution. In: International Journal of Quantum Chemistry. Band 107, Nr. 1, 2007, S. 247–258, doi:10.1002/qua.21059.
- Alessandro Dondoni, Pedro Merino: Comprehensive Heterocyclic Chemistry II. Pergamon, Oxford 1996, ISBN 978-0-08-096518-5, 3.06 - Thiazoles, S. 373–474, doi:10.1016/b978-008096518-5.00064-2.
- Datenblatt 2-Amino-thiazol, 97% bei Sigma-Aldrich, abgerufen am 23. Februar 2022 (PDF).
