1-(Trifluormethyl)-1,2-benziodoxol-3(1H)-on
1-(Trifluormethyl)-1,2-benziodoxol-3(1H)-on (Togni-Reagenz II) ist eine in der organischen Synthese zur direkten elektrophilen Trifluormethylierung verwendete Verbindung.[3]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1-(Trifluormethyl)-1,2-benziodoxol-3(1H)-on | ||||||||||||||||||
| Andere Namen |
Togni-Reagenz II | ||||||||||||||||||
| Summenformel | C8H4F3IO2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser, kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 316,02 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Methylenchlorid, Chloroform, Acetonitril, Methanol, Ethanol, Aceton[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Eine erste Beschreibung von Herstellung, Eigenschaften und Reaktivität der Verbindung erfolgte 2006 durch Antonio Togni und seine Mitarbeiter von der ETH Zürich.[4] Der Artikel enthält auch Informationen zu 1,3-Dihydro-3,3-dimethyl-1-(trifluormethyl)-1,2-benziodoxol (Togni-Reagenz I).
Gewinnung und Darstellung
Die Synthese erfolgt in einem dreistufigen Verfahren. Im ersten Schritt wird 2-Iodbenzoesäure in Gegenwart von Natriumperiodat eine Oxidation und Cyclisierung zum gemischten Anhydrid 1-Hydroxy-1,2-benziodoxol-3(1H)-on umgesetzt. Durch Acylierung mit Acetanhydrid und anschließende Substitution mit Trimethyl(trifluormethyl)silan entsteht die Zielverbindung.[1]
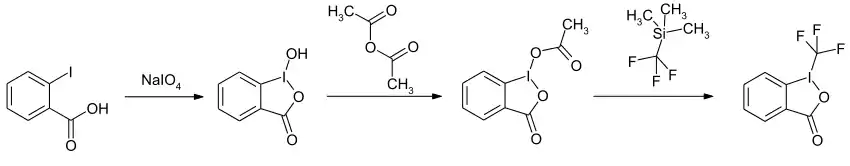
Eine neuere Eintopfsynthese geht ebenfalls von der 2-Iodbenzoesäure aus. Als Oxidationsmittel wird statt Natriumperiodat Trichlorisocyanursäure verwendet.[5]
Eigenschaften
Physikalische Eigenschaften
Die Verbindung kristallisiert in einer monoklinen Kristallstruktur. Die Raumgruppe ist P21/n mit vier Molekülen in der Elementarzelle.[4] Aus den kristallographischen Daten wurde eine Dichte von 2,365 g·cm−3 abgeleitet.[4]
Chemische Eigenschaften
Die reine Verbindung ist bei Raumtemperatur über Monate thermisch stabil. Oberhalb des Schmelzpunktes erfolgt eine heftige Zersetzung, wobei gasförmiges Trifluoriodmethan freigesetzt wird.[1] Die Zersetzung verläuft stark exotherm. In einer DSC-Messung wurde ab 149 °C eine Zersetzungswärme von −502 J·g−1 bzw. −158,6 kJ·mol−1 bestimmt.[6] Als Zersetzungsprodukte bei einer Rekristallisation aus Acetonitril wurden in geringer Menge Trifluormethyl-2-iodbenzoate und 2-Iodbenzoylfluorid beobachtet.[1] Die Prüfungen hinsichtlich explosionsgefährlicher Eigenschaften sind für den Stahlhülsentest und die Schlagempfindlichkeit positiv[6], für die Reibempfindlichkeit negativ.[7] Es handelt sich somit um einen explosionsgefährlichen Stoff. Die Verbindung reagiert heftig mit starken Basen und Säuren, sowie Reduktionsmitteln.[1] Im Lösungsmittel Tetrahydrofuran wird dessen Polymerisation initiiert.[1]
Verwendung
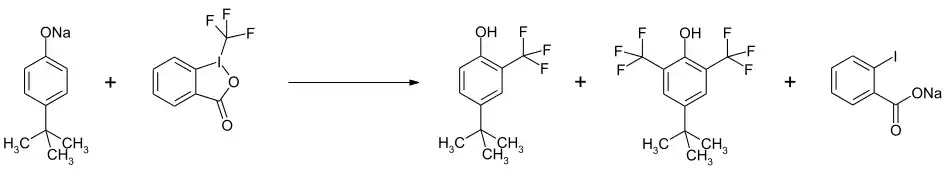
Die Verbindung wird zur Einführung der CF3-Gruppe in organische Verbindungen genutzt. Bei Phenolaten erfolgt eine Substitution in ortho-Stellung. Mit einem Überschuss kann eine zweifache Substitution erreicht werden.[8]
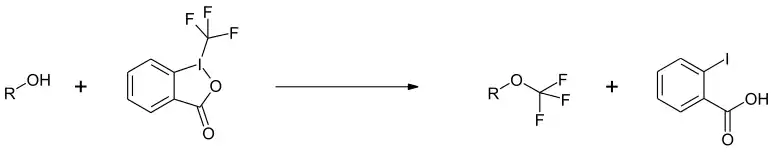
Mit Alkoholen ergeben sich die entsprechenden Trifluormethylether.[9]
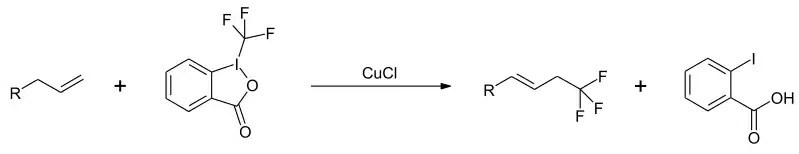
Eine Addition der CF3-Funktion kann unter Kupferkatalyse an terminale Olefine erfolgen.[10]
Einzelnachweise
- Kyrill Stanek, Raffael Koller, Iris Kieltsch, Patrick Eisenberger, Antonio Togni: 1-(Trifluoromethyl)-1,2-benziodoxol-3(1H)-one. In: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, 2001, ISBN 978-0-470-84289-8, doi:10.1002/047084289X.rn01121.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 1-Trifluoromethyl-1,2-benziodoxol-3(1H)-one (contains 60 % Diatomaceous earth) im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. Oktober 2020.
- I. Kieltsch, P. Eisenberger, K. Stanek, A. Togni: Recent Advances in Electrophilic CF3-Transfer Using Hypervalent Iodine(III) Reagents. In: Chimia. 62, 2008, S. 260–263, doi:10.2533/chimia.2008.260.
- Patrick Eisenberger, Sebastian Gischig, Antonio Togni: Novel 10-I-3 Hypervalent Iodine-Based Compounds for Electrophilic Trifluoromethylation. In: Chemistry – A European Journal. Band 12, Nr. 9, 2006, S. 2579–2586, doi:10.1002/chem.200501052.
- Václav Matoušek, Ewa Pietrasiak, Rino Schwenk, Antonio Togni: One-Pot Synthesis of Hypervalent Iodine Reagents for Electrophilic Trifluoromethylation. In: The Journal of Organic Chemistry. Band 78, Nr. 13, Juni 2013, S. 6763–6768, doi:10.1021/jo400774u.
- Nikolaus Fiederling, Jan Haller, Heiko Schramm: Notification about the Explosive Properties of Togni’s Reagent II and One of Its Precursors. In: Organic Process Research & Development. Band 17, Nr. 3, März 2013, S. 318–319, doi:10.1021/op400035b.
- Devoille, A.; Haller, J.: Facing the unknown with confidence: working with unidentified hazardous properties of chemical reagents. In: Chemistry Today 32(3) May/June 2014, 47–50.
- Kyrill Stanek, Raffael Koller, Antonio Togni: Reactivity of a 10-I-3 Hypervalent Iodine Trifluoromethylation Reagent With Phenols. In: The Journal of Organic Chemistry. Band 73, Nr. 19, September 2008, S. 7678–7685, doi:10.1021/jo8014825.
- Raffael Koller, Kyrill Stanek, Daniel Stolz, Raphael Aardoom, Katrin Niedermann, Antonio Togni: Zinc-Mediated Formation of Trifluoromethyl Ethers from Alcohols and Hypervalent Iodine Trifluoromethylation Reagents. In: Angewandte Chemie. Band 121, Nr. 24, 2009, S. 4396–4400, doi:10.1002/ange.200900974.
- Andrew T. Parsons, Stephen L. Buchwald: Copper-Catalyzed Trifluoromethylation of Unactivated Olefins. In: Angewandte Chemie. Band 123, Nr. 39, 2011, S. 9286–9289, doi:10.1002/ange.201104053.
