1,5-Dihydroxyanthrachinon
1,5-Dihydroxyanthrachinon, auch bekannt als Anthrarufin, ist eine organische Verbindung aus der Stoffgruppe der Anthrachinone (genauer der Dihydroxyanthrachinone).
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
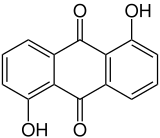 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,5-Dihydroxyanthrachinon | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C14H8O4 | |||||||||||||||
| Kurzbeschreibung |
Gelbes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 240,21 g·mol−1 | |||||||||||||||
| Aggregatzustand |
Fest | |||||||||||||||
| Schmelzpunkt |
280 °C[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Als Edward Schunk und H. Römer konzentrierte Schwefelsäure mit Methoxybenzoesäure vermengten, erhielten sie je ein in Wasser lösliches und unlösliches Produkt. Das unlösliche Produkt konnte erneut getrennt werden, indem es mit Barytwasser gewaschen wurde. Der unlösliche Teil enthielt das 1,5-Dihydroxanthrachinon, welches den Namen Anthrarufin bekam.[2]
Darstellung
Anthrarufin kann durch das Reagieren von konzentrierter Schwefelsäure mit Methoxybenzosäure hergestellt werden. Der erhaltene Niederschlag wird mit Wasser und Barytwasser gewaschen und mit Eisessig umkristallisiert. Die Ausbeute beträgt etwa 2 %.[2]
Eine andere Möglichkeit Anthrarufin zu gewinnen, ist Anthracen mit konz. Schwefelsäure zu vermischen. Nachdem etwa die Hälfte des Anthracens ins Lösung gegangen ist, fällt Anthrarufin durch erhitzen aus. Die Ausbeute beträgt hier etwa 45 %.[4]
H. Römer hat im Jahr 1883 eine weitere Reaktion beschrieben, in welcher Diamidoanthrachinone und/oder Dinitroanthrachinone in konz. Schwefelsäure gelöst werden. Durch Hinzugabe von Wasser und Kaliumnitrit und wiederholtem Erhitzen, erhält man ein Produkt, welches erneut in Kalilauge gelöst wird. Mit Salzsäure und Barytwasser lässt sich dann das reine Anthrarufin erhalten.[5]
Eigenschaften
Anthrarufin erzeugt mit konz. Schwefelsäure eine stark kirschrote Lösung, welche eine karminrote Fluoreszenz besitzt. Es reicht bereits ein Anteil von 10–2 % in konzentrierter Schwefelsäure um diese Färbung zu erzeugen. Mit einem Anteil von 10–6 % erhält man eine karmesinrote Lösung.[2]
Verwendung
Anthrarufin eignet sich nicht zum Beizen, da es keine Verfärbung verursacht.[5] Es kann jedoch durch Kalischmelze zu Oxyanthrarufin (1,2,5-Trihydroxyanthrachinon) umgewandelt werden. Dieses lässt sich zum Beizen verwenden, den es färbt ähnlich wie Alizarin.[5]
Es kann ebenfalls zu Alizarinsaphirol umgewandelt werden, welches ein besonders lichtechter Farbstoff ist. Dazu muss das Anthrarufin disulfoniert, dinitriert und reduziert werden.[6]
Einzelnachweise
- Datenblatt 1,5-Dihydroxyanthraquinone bei AlfaAesar, abgerufen am 24. Juli 2017 (PDF) (JavaScript erforderlich).
- E. Schunck, H. Römer: Ueber Anthrarufin, ein neues Bioxyanthrachinon aus der Metaoxybenzoësäure. In: Berichte der deutschen chemischen Gesellschaft. 11, 1878, S. 1176–1179, doi:10.1002/cber.187801101314.
- Datenblatt Anthrarufin bei Sigma-Aldrich, abgerufen am 5. Juli 2017 (PDF).
- C. Liebermann, K. Boeck: Ueber Anthracendisulfosäure und deren Umwandlung in Anthrarufin. In: Berichte der deutschen chemischen Gesellschaft. 11, 1878, S. 1613–1618, doi:10.1002/cber.18780110299.
- H. Roemer: Ueber 1, IV. Diorthonitroanthrachinon, 1, IV. Diorthoamidoanthrachinon und über eine neue Darstellungsweise des Anthrarufins. In: Berichte der deutschen chemischen Gesellschaft. 16, 1883, S. 363–372, doi:10.1002/cber.18830160188.
- Robert E. Schmidt: Kurzer Überblick über die Entwicklung der Anthrachinonfarbstoffe. In: Zeitschrift für angewandte Chemie. 41, 1928, S. 41–46, doi:10.1002/ange.19280410202.
