1,1′-Bi-2-naphthol
1,1′-Bi-2-naphthol (BINOL) ist eine organische Substanz, dessen (R)- oder (S)-Enantiomer meist als Ligand oder Auxiliar zur übergangsmetallkatalysierten asymmetrischen Synthese genutzt wird. BINOL besitzt axiale Chiralität (Atropisomerie). Die Enantiomere können getrennt werden und sind stabil gegen Racemisierung. Der spezifische Drehwert der beiden Enantiomere beträgt ± 33–38° (20 °C, 589 nm) (c=1, THF).[3] BINOL ist ein Vorläufer von BINAP, einem anderen chiralen Katalysator.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
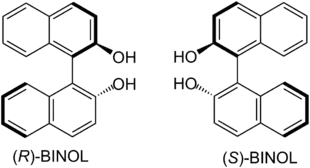 | ||||||||||
| Strukturformeln der beiden Binol-Enantiomere | ||||||||||
| Allgemeines | ||||||||||
| Name | 1,1′-Bi-2-naphthol | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C20H14O2 | |||||||||
| Kurzbeschreibung |
weißes bis beiges Pulver[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 286,32 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
gering löslich in Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
BINOL kann in hoher Ausbeute (90 %) aus 2-Naphthol in Gegenwart eines Kupfer(II)-Katalysators unter Luft- oder Sauerstoffzufuhr synthetisiert werden:[4]
Das Trennen der beiden Enantiomere kann beispielsweise mittels des ebenfalls chiralen (8S, 9R)-(−)-N-Benzylcinchonidiniumchlorids erfolgen.[5] Dabei können durch dessen Zugabe und mehrmaliges Lösen in Ethanol beide Enantiomere in hoher Ausbeute (70–75 %) isoliert werden.
Verwendung
(R)-(+)-Binol oder (S)-(−)-Binol (auch Derivate der reinen Enantiomere) wird überwiegend in der asymmetrischen Synthese verwendet.
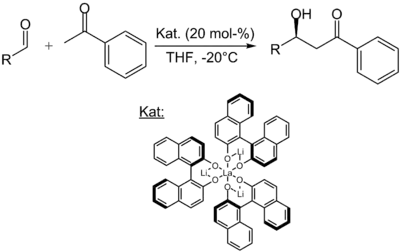
(R)-(+)-Binol oder (S)-(−)-Binol dient beispielsweise als Ligand eines Lanthanoids in der Shibasaki-Aldolreaktion, um unmodifizierte Ketone enantioselektiv an Aldehyde zu addieren:[6]
Vom (R)-(+)-Binol oder (S)-(−)-Binol abgeleitete Heterobimetallkatalysatoren werden auch in der enantioselektiven Addition von Phosphornukleophilen an Imine eingesetzt.[7][8]
Einzelnachweise
- Datenblatt 1,1′-Bi-2-naphthol bei AlfaAesar, abgerufen am 22. Februar 2010 (PDF) (JavaScript erforderlich).
- Datenblatt 1,1′-Bi-2-naphthol bei Sigma-Aldrich, abgerufen am 15. März 2011 (PDF).
- Datenblatt 1,1′-Bi-2-naphthol bei Acros, abgerufen am 22. Februar 2010.
- M. Noji, M. Nakajima, K. Koga: "A new catalytic system for aerobic oxidative coupling of 2-naphthol derivatives by the use of CuCl-amine complex: A practical synthesis of binaphthol derivatives", in: Tetrahedron Lett., 1994, 35 (43), S. 7983–7984; doi:10.1016/0040-4039(94)80028-6.
- Q.-S. Hu, D. Vitharana, L. Pu: An efficient and practical direct resolution of racemic 1,1′-bi-2-naphthol to both of its pure enantiomers, in: Tetrahedron: Asymmetry, 1995, 6 (9), S. 2123–2126; doi:10.1016/0957-4166(95)00280-3.
- J. Bülle, A. Hittermann: Das Basiswissen der Organischen Chemie, Thieme, Stuttgart 2000 (Eingeschränkte Vorschau in der Google-Buchsuche), S. 308.
- H. Gröger, Y. Saida, H. Sasai, K. Yamaguchi, J. Martens und M. Shibasaki: A New and Highly Efficient Asymmetric Route to Cyclic alpha-Amino Phosphonates: The first Catalytic Enantioselective Hydrophosphonylation of Cyclic Imines Catalyzed by Chiral Heterobimetallic Lanthanoid Complexes. In: J. Am. Chem. Soc. 120 (1998) 3089–3103, doi:10.1021/ja973872i.
- I. Schlemminger, Y. Saida, H. Gröger, W. Maison, N. Durot, H. Sasai, M. Shibasaki, J. Martens: Concept of Rigidity: How to Make Enantioselective Hydrophosphonylation of Cyclic Imines Catalyzed by Chiral Heterobimetallic Lanthanoid Complexes almost Perfect. In: J. Org. Chem. 65 (2000) 4818–4825, doi:10.1021/jo991882r.