γ-Glutamylcystein
γ-Glutamylcystein (γ-EC) ist ein Dipeptid aus den Aminosäuren Cystein und Glutaminsäure. In vielen Organismen kommt es als Vorstufe bei der Bildung von Glutathion vor. Im Gegensatz zur normalen Peptidbindung zwischen Aminosäuren ist hierbei die Aminogruppe des Cysteins nicht mit der α-Carboxygruppe der Glutaminsäure, sondern mit der γ-Carboxygruppe in der Seitenkette verbunden. Diese ungewöhnliche Bindung kann von den meisten Peptidasen nicht gespalten werden und verleiht γ-EC daher eine hohe Stabilität.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
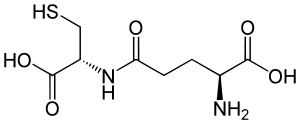 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | γ-Glutamylcystein | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C8H14N2O5S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 250,27 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Biologische Bedeutung
Die Thiolgruppe des γ-Glutamylcysteins ist weniger reaktiv als die in freiem Cystein und daher weniger empfindlich gegenüber spontaner Oxidation. Es wird daher angenommen, dass die Möglichkeit zur γ-Glutamylcystein-Bildung ursprünglich einen evolutionären Vorteil darstellte, da γ-Glutamylcystein eine bessere Speicherform für reduzierten Schwefel darstellt als Cystein. Eine weitere Reduktion der Neigung zur spontanen Oxidation wird in Gegenwart niedriger Ionenkonzentrationen durch die Bildung von Glutathion erreicht. In zur Glutathionsynthese fähigen Organismen ist die γ-Glutamylcystein-Konzentration daher meist sehr niedrig.
γ-Glutamylcystein kann unter Oxidation und Bildung einer Disulfidbrücke zu Bis-γ-Glutamylcystein dimerisieren und so als Reduktionsmittel dienen. Halobakterien können γ-Glutamylcystein synthetisieren aber kein Glutathion. Hier existiert eine NADPH-abhängige Bis-γ-Glutamylcystein Reduktase, so dass das γ-Glutamylcystein/Bis-γ-Glutamylcystein-System hier die Rolle des Glutathion/GSSG-Systems als Antioxidans übernehmen kann. In diesen Bakterien finden sich γ-Glutamylcystein-Konzentrationen im niedrigen millimolaren Bereich.[2]
Biosynthese
Die Synthese von γ-Glutamylcystein wird durch das Enzym Glutamatcysteinligase katalysiert. Die Reaktion ist mit der Spaltung eines Moleküls Adenosintriphosphat (ATP) zu Adenosindiphosphat (ADP) und Phosphat gekoppelt:
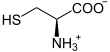 +
+ 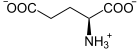 + ATP +
+ ATP + 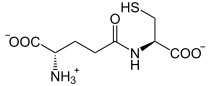 + ADP + Pi
+ ADP + Pi
Über die Glutathionsynthase kann durch Bindung eines Glycinmoleküls an die Cystein-Carboxygruppe des γ-Glutamylcysteins anschließend Glutathion gebildet werden.
Quellen
- Robert C. Fahey, Alfred R. Sundquist: Evolution of Glutathione Metabolism. In: Advances in Enzymology and Related Areas of Molecular Biology. Band 64, 1991, S. 1–53 (englisch).
Einzelnachweise
- Datenblatt γ-Glu-Cys bei Sigma-Aldrich, abgerufen am 26. April 2011 (PDF).
- Alfred R. Sundquist, Robert C. Fahey: The Function of y-Glutamylcysteine and Bis-y-glutamylcystine Reductase in Halobacterium halobium. In: Journal of Biological Chemistry. Band 264, Nr. 2, 1989, S. 719–725 (englisch, jbc.org [PDF]).
