β-Schleife
Eine β-Schleife (auch β-Kehre, englisch β-Turn, seltener Haarnadelschleife oder Haarnadelkehre) ist ein Sekundärstrukturmotiv von Peptiden und Proteinen. Sie kommt häufiger vor als die ähnlichen α-Schleifen, π-Schleifen oder γ-Schleifen.
Struktur
β-Schleifen bestehen aus vier Aminosäuren, wobei sich zwischen der Carbonylfunktion der ersten und Aminofunktion der vierten (bzw. der n- und (n+3)-) Aminosäure eine Wasserstoffbrückenbindung ausbildet. Diese Art der Verknüpfung wird deshalb auch als 4→1 geschrieben (entsprechend α-Schleife: 5→1, γ-Schleife: 3→1).
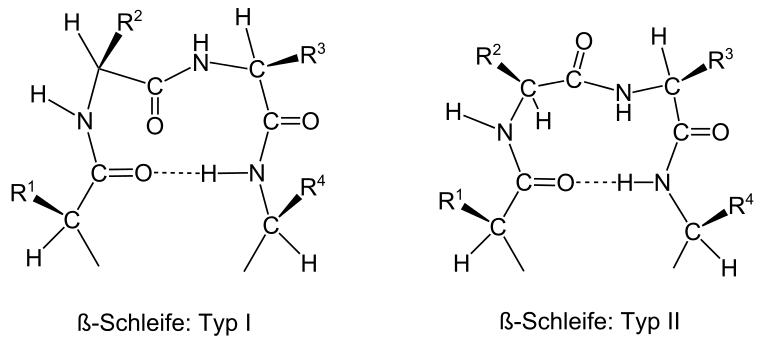
Subtypen
Je nach den Aminosäureresten wird zwischen βI-, βII- und βIII-Schleifen unterschieden:[1]
- Der βII-Typ besitzt aus sterischen Gründen meist (aber nicht immer) die Aminosäure Glycin an der dritten Position.[2]
- Der βIII-Typ kann beliebig wiederholt werden, wobei dann eine 310-Helix entsteht (3,0 Aminosäuren pro 360°-Drehung, 10-gliedriger Ring der Wasserstoffbrückenbindungen). Zum Vergleich, die α-Helix ist eine 3,613-Helix.
Funktion
Die β-Schleife ist, wie auch die anderen Schleifen, bei Richtungsänderungen in der Aminosäurekette in der Proteinstruktur zu beobachten. Sie verbindet zumeist β-Faltblatt-Strukturen. Da sie sich häufig an der Oberfläche von Proteinen befindet, beteiligt sie sich an der Interaktion zwischen Proteinen und anderen Molekülen.
Siehe auch
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6 Auflage, Spektrum Akademischer Verlag, Heidelberg 2007. ISBN 978-3-8274-1800-5.
- Donald Voet, Judith G. Voet: Biochemistry. 3. Auflage, John Wiley & Sons, New York 2004. ISBN 0-471-19350-X.
- Bruce Alberts, Alexander Johnson, Peter Walter, Julian Lewis, Martin Raff, Keith Roberts: Molecular Biology of the Cell, 5. Auflage, Taylor & Francis 2007, ISBN 978-0-8153-4106-2.
Einzelnachweise
- Thomas Carell, LMU München: Vorlesungsscript Peptide und Proteine (Memento vom 4. März 2016 im Internet Archive), S. 11, abgerufen am 5. November 2013.
- Saul R. Trevino, Stephanie Schaefer, J. Martin Scholtz, C. Nick Pace (2008): Increasing Protein Conformational Stability by Optimizing β-turn Sequence. Journal of Molecular Biology 373 (1): 211–218. doi:10.1016/j.jmb.2007.07.061