Ölsäureamid
Ölsäureamid ist das Carbonsäureamid der Ölsäure. Es wird im Körper gebildet und zählt infolgedessen zu den endogenen Substanzen. Dort liegt es als cis-Isomer vor und ist an einer Reihe von Signalprozessen beteiligt. Industriell wird es vor allem bei der Kunststoffherstellung verwendet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
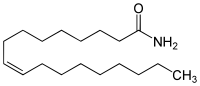 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ölsäureamid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C18H35NO | ||||||||||||||||||
| Kurzbeschreibung |
weiche, fettartige, schwach bräunliche Substanz[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 281,48 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Ölsäureamid ist – wie Ölsäure oder das verwandte Anandamid – eine wasserunlösliche Substanz. Es ist eine weiche, fettartige, schwach bräunliche Substanz. Technisches Ölsäureamid enthält 20 % gesättigte Amide als Nebenbestandteile und wird durch Erhitzen von Ammoniumoleat gewonnen.[2] industriell, analog zu anderen Fettsäureamiden, durch die Reaktion von Ölsäure mit Ammoniak.[4]
Biologische Bedeutung
Ölsäureamid wurde im Liquor cerebrospinalis von Katzen gefunden, die unter Schlafentzug gehalten wurden. Es wurde zunächst als „Cerebrodien“ bezeichnet, da man annahm, dass es sich um ein Dien handle.[5] Kurze Zeit später wurde es schließlich als das „cis“-Isomer des Ölsäureamids identifiziert.[6]
Ölsäureamid zeigt Schlaf-induzierende Wirkung und Hypomotilität.[7] Es interagiert mit Kaliumkanälen und mit GABAA- sowie 5-HT7-Rezeptoren.[8] Die Interaktion mit den GABAA-Rezeptoren scheint dabei die schlafinduzierende Wirkung zu verursachen.
Es konnte gezeigt werden, dass Ölsäureamid mit dem Cannabinoid-Rezeptor 1 (CB1-Rezeptor) direkt interagiert.[9][10] Es aktiviert auch Vanilloid-TRPV1-Rezeptoren.
Ob es aber als Endocannabinoid gezählt werden kann, ist trotz der Cannabinoid-ähnlichen Effekte (erhöhter Appetit, Hypothermie, Hypoaktivität) noch umstritten.[11]
Ölsäureamid wird durch die Fettsäureamid-Hydrolase (FAAH) abgebaut.
Biochemische Darstellung
Der genaue de novo-Syntheseweg von Ölsäureamid ist noch nicht ganz geklärt.[8] Es wird aber vermutet, dass Ölsäureamid ausgehend von Oleoyl-CoA und Glycin gebildet wird. Hierbei sollen Glycin und Oleoyl-CoA enzymatisch zu Oleoylglycin kondensieren, was durch die Gallensäure-CoA:Aminosäure N-Acetyltransferase (BACAT) bzw. ein BACAT-ähnliches Enzym katalysiert wird.[12][13] Anschließend kann Oleoylglycin oxidativ zu Ölsäureamid durch das Enzym PAM (Peptidylglycin-α-amidating monooxygenase) umgesetzt werden. Alternativ könnte Ölsäureamid durch direkte Umsetzung von Oleoyl-CoA und Ammoniak entstehen, was durch Cytochrom c katalysiert wird.[14] Möglicherweise führt auch eine Kombination der beiden Wege zur Biosynthese Ölsäureamids.[15]
Ob die Fettsäureamid-Hydrolase (FAAH) aus Ölsäure und Ammonium (NH4+) Ölsäureamid bilden kann (Rückreaktion des Abbaus) wird bezweifelt.[15] Dem steht gegenüber, dass sowohl sehr hohe Konzentrationen an NH4+ benötigt würden und die Reaktion ein pH-Optimum bei mehr als 9 hat.[15] Diese Bedingungen sind physiologisch sehr schwer zu erreichen.
Elaidinsäureamid
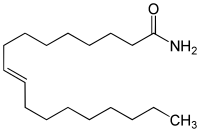
Elaidinsäureamid, das trans-Isomer von Ölsäureamid, ist zwar biologisch aktiv, jedoch viel weniger als das cis-Isomer. Viele beim cis-Isomer beobachtete Effekte sind zudem beim trans-Isomer nicht nachweisbar.
Technische Verwendung
Ölsäureamid findet Anwendung in der Kunststoffproduktion. Dort dient es als Gleitmittel und erleichtert beispielsweise das Aneinandergleiten von Kunststofffolien. Es ist auch ein Hydrophobierungsmittel und kann auch als Rohstoff für die Kosmetikherstellung verwendet werden. Schließlich wird es als Slipmittel bei Polyethylen- und (neben Erucasäureamid) bei Polypropylenprodukten genutzt.[16]
Vor kurzem konnte gezeigt werden, dass das in Polypropylen-Reaktionsgefäßen enthaltene Ölsäureamid auch in Lösung gelangen kann. Dieses könnte anschließend biochemische Experimente beeinträchtigen.[17]
Literatur
- CR. Hiley, PM. Hoi: Oleamide: a fatty acid amide signaling molecule in the cardiovascular system? In: Cardiovasc Drug Rev.,2007, 25(1), S. 46–60; PMID 17445087.
Einzelnachweise
- Eintrag zu OLEAMIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- Eintrag zu Ölsäureamid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Juni 2014.
- Datenblatt Oleamide bei Sigma-Aldrich, abgerufen am 26. April 2011 (PDF).
- A. Werdehausen, H. Weiss, H. Schütt: Carboxylic acid amide preparation, Patent US 3,816,483, 1970 (Henkel).
- RA. Lerner et al.: Cerebrodiene: a brain lipid isolated from sleep-deprived cats. In: PNAS, 1994, 91(20), S. 9505–9508; PMID 7937797; PMC 44841 (freier Volltext).
- BF. Cravatt et al.: Chemical characterization of a family of brain lipids that induce sleep. In: Science, 1995, 268(5216), S. 1506–1509; PMID 7770779; doi:10.1126/science.7770779.
- AS. Basile et al.: Characterization of the hypnotic properties of oleamide. In: Neuroreport, 1999, 10(5), S. 947–951; PMID 10321465.
- CR. Hiley, PM. Hoi: Oleamide: a fatty acid amide signaling molecule in the cardiovascular system? In: Cardiovasc Drug Rev., 2007, 25(1), S. 46–60; PMID 17445087.
- JF. Cheer et al.: Modification of 5-HT2 receptor mediated behaviour in the rat by oleamide and the role of cannabinoid receptors. In: Neuropharmacology, 1999, 38(4), S. 533–541; PMID 10221757; doi:10.1016/S0028-3908(98)00208-1.
- S. Huitrón-Reséndiz et al.: Effect of Oleamide on Sleep and Its Relationship to Blood Pressure, Body Temperature, and Locomotor Activity in Rats. In: Experimental Neurology, 2001, 172(1), S. 235–243; doi:10.1006/exnr.2001.7792.
- CJ. Fowler: Oleamide: a member of the endocannabinoid family? In: Br J Pharmacol., 2004, 141(2), S. 195 f.; PMID 14691053; PMC 1574195 (freier Volltext).
- J. O’Byrne et al.: The human bile acid-CoA:amino acid N-acyltransferase functions in the conjugation of fatty acids to glycine. In: J Biol Chem., 2003, 278(36), S. 34237–34244; PMID 12810727; PDF (Volltextzugriff, engl.).
- S. Chaturvedi et al.: In vivo evidence that N-oleoylglycine acts independently of its conversion to oleamide. In: Prostaglandins Other Lipid Mediat., 2006, 81(3-4), S. 136–149; PMID 17085322; PMC 1712674 (freier Volltext).
- WJ. Driscoll et al.: Oleamide synthesizing activity from rat kidney: identification as cytochrome c. In: J Biol Chem., 2007, 282(31), S. 22353-22363 (englisch); PMID 17496328; jbc.org (PDF).
- EK. Farrell, DJ. Merkler: Biosynthesis, degradation and pharmacological importance of the fatty acid amides. In: Drug Discov Today, 2008, 13(13–14), S. 558–568; PMID 18598910; doi:10.1016/j.drudis.2008.02.006.
- P. Eyerer (Hrsg.), P. Elsner (Hrsg.) T. Hirth (Hrsg.): Die Kunststoffe und ihre Eigenschaften. 6. neu bearb. und erw. Auflage. Springer-Verlag, 2004, ISBN 3-540-21410-0, S. 157.
- RG. McDonald et al.: Bioactive Contaminants Leach from Disposable Laboratory Plasticware. In: Science, 2008, 322(5903), S. 917; PMID 18988846; doi:10.1126/science.1162395.
