Zellviabilität
Zellviabilität (Zelllebensfähigkeit, Lebendzellanteil, englisch cell viability) bezeichnet in der Zellbiologie und Mikrobiologie den Anteil lebender Zellen in einer Zellpopulation.
Eigenschaften
Die Anzahl toter Zellen und die Anzahl lebender Zellen (Lebendzellzahl) ergeben zusammen die Gesamtzellzahl. Die Gesamtzellzahl kann z. B. mit einer Zählkammer unter einem Mikroskop, mit einem Durchflusszytometer oder einem Coulter-Zähler bestimmt werden. Der Tod einer Zelle erfolgt über zwei Mechanismen, die Nekrose und die Apoptose. Die Vitalfärbung ist dagegen keine Methode zur Bestimmung der Zellviabilität, sondern bezeichnet Verfahren zur Färbung von Zellen, ohne sie dabei zu töten.
Der IC50-Wert (engl. inhibitory concentration of half-maximal effect) gibt bei Untersuchungen zur Zytotoxizität die Konzentration einer Substanz an, welche die Zellviabilität um 50 % senkt. In einigen Publikationen wird auch der LC50-Wert (engl. lethal anstatt inhibitory) verwendet, der in diesem Zusammenhang aber identisch mit dem IC50-Wert ist. Dieser Wert ist beispielsweise für die Wirksamkeit von Chemotherapeutika oder auch Desinfektionsmitteln von Interesse. Je kleiner die notwendige Konzentration bzw. die Dosis ist, desto höher ist die Wirksamkeit.
Nachweisverfahren
Es ist eine Vielzahl von Tests zur Bestimmung der Zellviabilität auf dem Markt, die nach verschiedenen Messprinzipien arbeiten.[1] Die Verfahren umfassen mikroskopische, fluorimetrische, colorimetrische, luminometrische, durchflusscytometrische und Impedanzänderungsbasierte Methoden. Bei koloniebildenden Mikroorganismen erfolgt meistens ein Surface-viable Count.
Nachweisprinzipien
Viabilitätsnachweise basieren auf Eigenschaften lebender Zellen wie Endozytose, enzymatische Aktivität, Unversehrtheit der Zellmembran oder Vermehrung. Da jede Methode Schwächen aufweist, werden teilweise fluoreszierende Doppelfärbungen zum gleichzeitigen Nachweis von Apoptose und Nekrose durchgeführt, wie z. B. die Vital-Fluoreszenz-Doppelfärbung mit Propidiumiodid (PI) und Annexin V (siehe unten). Doppelt gefärbte Zellen mit Annexin V und PI zeigen tote Zellen an, während einfach PI-gefärbte Zellen als nekrotisch und einfach AnnexinV-gefärbte Zellen als apoptotisch klassifiziert werden. Im Folgenden ist zu beachten, dass die aufgeführten Nachweise entweder lebende oder tote Zellen nachweisen.
Messung lebender Zellen
Endozytosenachweise
Diese Viabilität kann zum Beispiel im Neutralrot-Test durch die Aufnahme des Vitalfarbstoffes Neutralrot (engl. Neutral Red Uptake, NRU) in Zell-Lysosomen durch Endozytose angezeigt werden.[2]
Enzymatische Nachweise

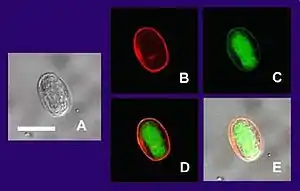
Weiterhin werden auch Nachweise enzymatischer Aktivität durchgeführt, die in toten Zellen abnimmt, jedoch teilweise noch vorhanden sein kann. Diese Nachweise färben daher vorwiegend lebende Zellen.
Als Esterasenachweise werden Calcein AM oder Fluorescein-Diacetat[3] eingesetzt. Ebenso kann auch die Aktivität der Lactat-Dehydrogenase (LDH) gemessen werden.
Der Redoxindikator Resazurin[4][5], Hydroethidin[6], der MTT-Test mit 3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazoliumbromid[2][7][8] oder seinem Analogon XTT sowie die Luciferase-basierten Verfahren[9] weisen über das Redoxpotential indirekt die Glykolyserate lebender Zellen nach.
Bromdesoxyuridin (BrdU) wird zum Nachweis der DNA-Replikation von wachsenden Zellen verwendet.[10]
Der WST-1-Assay (water soluble tetrazolium) dient zum Nachweis einer intakten Atmungskette in Zellen.[2][11] Viable Zellen mit einem intakten mitochondrialen Succinat-Tetrazolium Dehydrogenase System bewirken eine enzymatische Umsetzung des schwach rot gefärbten Tetrazoliumsalzes WST-1 (4-[3-(4-Iodophenyl)-2-(4-nitrophenyl)-2H-5-tetrazolio]-1,3-Benzol-Disulfonat) in das dunkelrote Formazan. Dieser Farbumschlag kann in einem Spektralphotometer photometrisch gemessen und ausgewertet werden[12].
Proliferationsnachweise
Die Messung der Zunahme an wachsenden Zellen in einem gegebenen Zeitraum erlaubt über die Wachstumsrate und die Generationszeit die Viabilität zu bestimmen.
Messung toter Zellen
Apoptosenachweise
Ein Nachweis der Apoptose kann mit Annexin V, mit Yo-Pro[6] oder über die TUNEL-Methode erfolgen. Nicht alle toten Zellen untergehen einer Apoptose, bei mechanischer Überbelastung sterben Zellen durch Risse in den Zellmembranen (siehe Nekrose).
Perforationsnachweise

Diffusionsbasierte Verfahren verwenden die Perforationsfarbstoffe Trypanblau,[15] Brillantblau FCF,[2] Kristallviolett oder die DNA-interkalierenden Fluoreszenzfarbstoffe 4′,6-Diamidin-2-phenylindol (DAPI),[16] Ethidiumbromid oder Propidiumiodid,[16] die durch perforierte Zellmembranen in tote Zellen eindringen können. Lebende Zellen werden dagegen kaum gefärbt. Perforationsnachweise erfordern aufgrund einer (wenn auch deutlich geringeren) Farbstoffdiffusion auch bei lebenden, intakten Zellen eine zügige Auszählung nach Zugabe des Farbstoffs.
Literatur
- Richtlinie 2000/33/EG der Kommission vom 25. April 2000 zur siebenundzwanzigsten Anpassung der Richtlinie 67/548/EWG des Rates zur Angleichung der Rechts- und Verwaltungsvorschriften der Mitgliedstaaten für die Einstufung, Verpackung und Kennzeichnung gefährlicher Stoffe an den technischen Fortschritt. In: Amtsblatt der Europäischen Gemeinschaften. Anhang 1: B.40. Prüfung auf hautätzende Wirkungen. Beispiel MTT-Reduktionstest.
- M. D. Hall, A. Simeonov, M. I. Davis: Avoiding Fluorescence Assay Interference-The Case for Diaphorase. In: Assay and Drug Development Technologies. Band 14, Nummer 3, April 2016, S. 175–179, doi:10.1089/adt.2016.707, PMID 27078679, PMC 4840916 (freier Volltext).
Einzelnachweise
- Übersicht über Messverfahren zur Bestimmung der Zellviabilität und Proliferation
- L. Schröterová, V. Králová, A. Vorácová, P. Hasková, E. Rudolf, M. Cervinka: Antiproliferative effects of selenium compounds in colon cancer cells: comparison of different cytotoxicity assays. In: Toxicol Vitro. (2009) Bd. 23(7), S. 1406–1411. PMID 19607906.
- D. W. R. Gray, et al.: The use of fluorescein diacetate and ethidium bromide as a viability stain for isolated islets of Langerhans. In: Stain Technology 62/1987 S. 373–381.
- E. M. Czekanska: Assessment of cell proliferation with resazurin-based fluorescent dye. In: Methods Mol Biol. (2011) Bd. 740, S. 27–32. PMID 21468965.
- E. Matteucci, O. Giampietro: Flow cytometry study of leukocyte function: analytical comparison of methods and their applicability to clinical research. In: Curr Med Chem. (2008) Bd. 15(6), S. 596–603. Review. PMID 18336274.
- C. Mehanna, C. Baudouin, F. Brignole-Baudouin: Spectrofluorometry assays for oxidative stress and apoptosis, with cell viability on the same microplates: a multiparametric analysis and quality control. In: Toxicol In Vitro. (2011) Bd. 25(5), S. 1089–1096. PMID 21419213.
- V. N. Sumantran: Cellular chemosensitivity assays: an overview. In: Methods Mol Biol. (2011) Bd. 731, S. 219–36. PMID 21516411.
- Einführung in die in-vitro Testung (Memento vom 13. Juni 2007 im Internet Archive)
- M. C. Didiot, S. Serafini, M. J. Pfeifer, F. J. King, C. N. Parker: Multiplexed reporter gene assays: monitoring the cell viability and the compound kinetics on luciferase activity. In: J Biomol Screen. (2011) Bd. 16(7), S. 786–93. PMID 21693766.
- Y. Lu, F. Jiang, H. Jiang, K. Wu, X. Zheng, Y. Cai, M. Katakowski, M. Chopp, S. S. To: Gallic acid suppresses cell viability, proliferation, invasion and angiogenesis in human glioma cells. In: Eur J Pharmacol. (2010) Bd. 641(2-3), S. 102–7. PMID 20553913. PMC 3003697 (freier Volltext).
- A. V. Peskin, C. C. Winterbourn: A microtiter plate assay for superoxide dismutase using a water-soluble tetrazolium salt (WST-1). In: Clinica Chimica Acta. Bd. 293, 2000, S. 157–166. PMID 10699430.
- Zimmermann I., Kollaterale Chemosensitivität / - resistenz bei akuten myeloischen Leukämien, Dissertation 2006, LMU München
- R. Clothier, E. Gottschalg, S. Casati, M. Balls: The FRAME alternatives laboratory database. 1. In vitro basal cytotoxicity determined by the Kenacid blue total protein assay. In: Altern Lab Anim. (2006) Bd. 34(2), S. 151–75. PMID 16704290.
- H. Hurst, R. H. Clothier, M. Pratten: An evaluation of the chick cardiomyocyte micromass system for identification of teratogens in a blind trial. In: Reprod Toxicol. (2009) Bd. 28(4), S. 503–10. PMID 19646523.
- M. J. Stoddart: Cell viability assays: introduction. In: Methods Mol Biol. (2011) Bd. 740, S. 1–6. PMID 21468961.
- P. Chrenek, A. V. Makarevich, M. Simon: Viability and apoptosis in spermatozoa of transgenic rabbits. In: Zygote. (2012) Bd. 20(1), S. 33–7. PMID 21144118.