Zählkammer
Eine Zählkammer, auch als Hämozytometer bezeichnet, dient der lichtmikroskopischen Zählung aller Arten von kleinen Teilchen, die sich in einer Teilchensuspension befinden. Zählkammern werden besonders für die Quantifizierung von Zellen (zum Beispiel Erythrozyten, Leukozyten) und Mikroorganismen in der Medizin und Biologie angewendet.[1]

Prinzip
Eine Zählkammer ist im Prinzip ein virtueller Ausschnitt aus einem Zwischenraum, der durch zwei ebene, in geringem Abstand parallel angeordnete Glasflächen begrenzt wird. Die Zählkammer wird auf einer Glasplatte, ähnlich den für lichtmikroskopische Untersuchungen verwendeten Objektträgern, gebildet. Diese ist jedoch dicker (etwa 5 mm) und weist eine besondere Ausbildung der Oberfläche auf. Eine dünne, genau plangeschliffene und polierte Glasscheibe, das sogenannte Deckglas, wird in einer bestimmten Höhe parallel über der dickeren, größeren Grundplatte angeordnet. Durch Strichmarkierungen auf der Oberfläche der Grundplatte wird ein zwischen Grundfläche und Unterseite des Deckglases befindlicher Raum markiert, dessen Volumen durch die markierte Grundfläche und den Abstand zwischen Grundfläche und Deckglasunterseite (Kammerhöhe) bestimmt ist. Dieser Raum mit bekanntem Volumen ist die eigentliche Zählkammer. Zählt man mikroskopisch nach Einbringen einer Teilchensuspension in diese Kammer die in dem markierten Volumen vorhandenen Teilchen, ergibt sich aus deren Zahl und dem Volumen die Konzentration der Teilchen.
Technische Einzelheiten
Die Grundplatte der Zählkammer besteht aus optischem Spezialglas und hat die Größe eines normalen Objektträgers für die Durchlichtmikroskopie, nämlich: 76 mm × 26 mm (nach DIN ISO 8037–1), ist jedoch etwa 5 mm dick. Durch parallel zu den Schmalkanten eingefräste Nuten wird die Oberfläche der Grundplatte in 2 breite Felder (außen) und 3 schmale Stege (innen) geteilt. Im Unterschied zu den beiden äußeren Feldern, die der Beschriftung dienen, sind die Stege plangeschliffen und poliert. Der Mittelsteg (Kammerboden) liegt um den Betrag der Höhe der Zählkammer niedriger als die beiden seitlich davon liegenden Stege. Diese beiden Stege bilden die Auflage des Deckglases (Trägerstege). Wird das Deckglas auf diese beiden Stege gelegt, befindet sich seine Unterfläche in der beabsichtigten Höhe (Kammertiefe) über der Oberfläche des Mittelstegs, der Grundfläche der Kammer (Kammerboden). In die Grundfläche sind die Markierungen zur Abgrenzung des beabsichtigten Volumens eingraviert. Der Zwischenraum zwischen Grundfläche (Kammerboden) und Unterfläche des Deckglases sowie die Strichmarkierungen auf der Grundfläche umgrenzen das Volumen der Zählkammer.
Der Kammerboden des Mittelstegs liegt in der Regel 0,1 mm tiefer als die beiden Außenstege (Kammertiefe). Für sehr kleine Partikel, beispielsweise Bakterien, beträgt die Kammertiefe nur 0,02 mm. In der Mitte der Grundfläche der Zählkammer befindet sich ein je nach Kammertyp unterschiedliches Liniennetz (Zählfläche, Zählnetz). In der Regel sind zwei Zählnetze eingraviert, die durch eine Nut voneinander getrennt sind. Die seitliche Begrenzung des auszuzählenden Volumens wird durch die gedachten Ebenen in senkrechter Projektion auf die Grenzlinien der Zählnetze gebildet. Die Deckgläser für Zählkammern unterscheiden sich von Deckgläsern für normale Lichtmikroskopie durch die plangeschliffenen und polierten Oberflächen. Außerdem sind sie etwas dicker als normale Deckgläser, damit sie nicht durch Kapillarkräfte durchgebogen werden. Je nach Zählkammer-Typ ist ihre Größe (L × B) 24 mm × 24 mm, 20 mm × 26 mm oder 22 mm × 30 mm mit einer Dicke von jeweils 0,4 mm.
Weil die Zählkammern oft für die Bestimmung der Konzentration von Blutzellen verwendet werden, werden sie auch als Hämocytometer und die Deckgläser als Hämocytometer-Deckgläser bezeichnet.
Vorbereitung der Kammer
Die Kammer sollte vor Gebrauch möglichst frei von Staub, Fusseln und Zellen sein. Zum korrekten Aufsetzen des Deckglases schiebt man es mit etwas Druck (Vorsicht, Bruchgefahr!) im Querformat auf die beiden Trägerstege auf. Wenn das Deckglas auf den Trägerstegen korrekt aufsitzt, sind sogenannte Newtonsche Interferenzfarben zu sehen. Das bedeutet, die Höhe des Zwischenraums zwischen den Trägerstegen und dem Deckglas liegt in der Größenordnung der Lichtwellenlängen, ist also zu vernachlässigen. In diesem Zustand verrutscht das Deckglas beim Kippen der Zählkammer nicht.
Beschickung der Kammer
Die auszuzählende Teilchensuspension wird bei aufgelegtem Deckglas seitlich aufpipettiert und saugt sich durch Kapillarkraft in den Zwischenraum. Die Teilchensuspension wird so in einer Schicht mit genau bekannter Dicke ausgebreitet. Nach Auszählung der auf den Zählfeldern liegenden Teilchen unter dem Lichtmikroskop bei Durchlicht lässt sich deren Anzahl je Volumeneinheit errechnen. Bei Zellen kann zur besseren Erkennbarkeit neben ihrer Anfärbung auch Phasenkontrastmikroskopie verwendet werden.
Reinigung
Nach Benutzung sollte man Kammer und Deckglas vorsichtig mit einem fusselfreien Einmaltuch von der Teilchensuspension befreien und mit 70 % 2-Propanol oder einem ähnlichen Desinfektionsmittel reinigen und trocknen. Hierbei ist vor allem das Deckglas mit Vorsicht zu behandeln, da dieses plangeschliffen und daher um einiges teurer als ein normales Deckglas ist.
Zählweise

Je nach Typ der auszuzählenden Teilchen wird eine gewisse Anzahl Groß- oder Gruppenquadrate ausgezählt und daraus ein Mittelwert gebildet. Multipliziert man diesen Wert mit einem entsprechenden Faktor (Kehrwert des Produkts aus Quadratfläche und Kammerhöhe), erhält man die Teilchenzahl pro Volumeneinheit. Wichtig beim Zählen ist, dass man auf Grenzlinien liegende Teilchen nicht doppelt zählt. Hierzu ist es üblich, bei der Auszählung eines Quadrates nur die Teilchen auf zwei Grenzlinien (z. B. oben und links) mitzuzählen und die auf den anderen beiden Linien liegenden nicht. Vor der Auszählung ist es ratsam, das gesamte Linienraster mit einer geringen Vergrößerung zu betrachten und zu prüfen, ob die Teilchen einigermaßen gleichmäßig über die Quadrate verteilt sind. Andernfalls sollte die Teilchensuspension nochmal aufgeschüttelt und neu aufgebracht werden. Eine ungleichmäße Verteilung erkennt man auch daran, dass sich bei der Auszählung mehrerer Quadrate stark schwankende Teilchenzahlen pro Quadrat ergeben.
Bei einer so geringen Flächendichte der Teilchen wie im Beispiel rechts, müssen sehr viele Quadrate ausgezählt werden, um ein verwendbares Ergebnis zu bekommen. Bei hohen Teilchenkonzentrationen (z. B. Hefesuspensionen) muss durch Verdünnen eine Auszählbarkeit hergestellt werden. Anzustreben ist etwa 1 Teilchen pro kleines Quadrat.
Leukozytenzählung
Hierzu werden 4 große Eckquadrate ausgezählt und man teilt diese Anzahl durch 4, um einen Mittelwert pro Eckquadrat zu erhalten. Dieser Wert wird mit 10 multipliziert und man erhält damit die Anzahl der Zellen je µl (Mikroliter). Der Faktor 10 ergibt sich dadurch, dass jedes Eckquadrat eine Fläche von 1 mm² hat und die Kammerhöhe 0,1 mm beträgt, also ein Eckquadrat einem Volumen von 0,1 µl (1 mm² × 0,1 mm = 0,1 mm³) entspricht. Also ergibt die Zellzahl pro Eckquadrat, also je 0,1 mm³, mit 10 multipliziert die Zellzahl je mm³. Eine entsprechende Verdünnung, die man vor Aufbringen der Zellsuspension auf die Kammer (zwangsläufig) gemacht hat, muss natürlich auch noch berücksichtigt werden.
Erythrozytenzählung
Um die Zahl kleinerer Zellen wie z. B. Erythrozyten oder CHO-Zellen in Zellkulturen zu bestimmen, werden viermal 5 Gruppenquadrate ausgezählt und so der Mittelwert für 5 Gruppenquadrate ermittelt. Diese Zahl mal 50 ergibt die Zellzahl pro µl (1 / (5 × 0,04 mm² × 0,1 mm) = 50). Auch hier ist eine eventuell zuvor gemachte Verdünnung zu berücksichtigen.
Zählkammertypen
Die Zählkammertypen unterscheiden sich im Wesentlichen durch die Art des Zählgitters
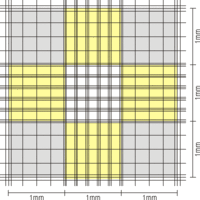
Zählkammer nach Neubauer
Das Zählgitter besteht bei der Neubauer-Zählkammer aus 3 × 3 Großquadraten von je 1 mm Kantenlänge und somit einer Fläche von je 1 mm². Das zentrale Großquadrat ist bei der Neubauer improved-Zählkammer wiederum in 5 × 5 kleinere Gruppenquadraten mit je 0,2 mm Kantenlänge unterteilt. Die Fläche eines solchen Gruppenquadrats ist damit 0,04 mm². Eine Besonderheit bei der Neubauer improved sind die dreifachen Begrenzungslinien der Gruppenquadrate, bei welchen die mittlere Linie die eigentliche Begrenzung zwischen zwei Feldern darstellt.
Bei der alten Neubauer-Zählkammer (entspricht der Thoma-Zählkammer, siehe unten) ist das mittlere Großquadrat in 4 × 4 Gruppenquadrate von ebenfalls 0,2 mm Kantenlänge unterteilt. Diese sind auch durch dreifache Grenzlinien getrennt, von denen aber nur jeweils die linke bzw. rechte als eigentliche Begrenzung anzusehen ist. Außerdem sind die Dreifachlinien nur an 2 Seiten zu finden.
| Unterschied Mittleres Quadrat Neubauer alt und verbessert | |
|---|---|
| (Mit gelb bzw. grau sind je zwei Gruppenquadrate markiert) | |
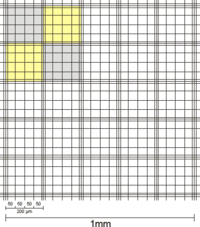 Gruppenquadrate der Neubauer improved |
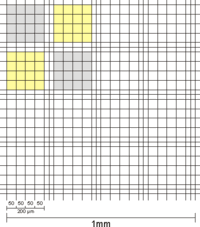 Gruppenquadrate der alten Neubauer |
| Neubauer improved | Neubauer- und Thoma-Zählkammer |
Weiterhin ist jedes Gruppenquadrat in 4 × 4 Kleinstquadrate mit je 0,05 mm Kantenlänge mit je 0,0025 mm² Fläche eingeteilt.
Andere Zählkammermodelle
- Neubauer improved: doppelte Netzteilung. Das Zählnetz zeigt 9 Großquadrate von je 1 mm². Die 4 Großquadrate in den Ecken sind in je 16 Quadrate mit 0,25 mm Seitenlänge unterteilt. Sie werden für die Leukozytenzählung verwendet. Das Großquadrat in der Mitte ist in 25 Gruppenquadrate mit je 0,2 mm Seitenlänge unterteilt. Jedes Gruppenquadrat besteht aus 16 Kleinstquadraten mit je 0,05 mm Seitenlänge und einer Fläche von 0,0025 mm². Die (von links oben) diagonalen 5 Gruppenquadrate werden für die Thrombozyten- und Erythrozytenzählung verwendet. Besondere Beachtung verdient, dass alle Gruppenquadrate allseitig dreifache Grenzlinien aufweisen. Die mittlere Linie ist die Begrenzungslinie und entscheidet darüber, ob Zellen im Grenzbereich mitzuzählen sind oder nicht.
- Neubauer improved, hell-linig: doppelte Netzteilung. Gleiches Zählnetz wie Neubauer improved, jedoch Kammerboden mit Rhodium verspiegelt. Das Zählnetz ist in die Rhodiumschicht eingraviert und erscheint bei normaler Einstellung des Mikroskops hell. Durch Kontrastverschiebung ist unter dem Mikroskop eine Farbumkehr möglich, so dass das Zählnetz je nach Erfordernis hell- oder dunkellinig erscheint*
- Thoma: doppelte Netzteilung. Die Netzteilung entspricht dem in der Mitte liegenden Großquadrat der Neubauer-Kammer. Die Fläche der Kleinstquadrate beträgt jeweils 0,0025 mm². Da die äußeren Großquadrate nicht ausgeführt sind, wird das Thoma-Kammersystem nur zum Auszählen von Thrombo- und Erythrozyten verwendet.
- Thoma (neu): (entspricht Neubauer improved ohne ausgeführte Eckquadrate und mit anderer Begrenzungsdarstellung).
- Türk (entspricht der alten Neubauer- bzw. Thoma-Kammer mit dem Unterschied, dass die Eckquadrate mit Doppellinien unterteilt sind)
- Agasse-Lafont in Standard- und Bright-Lined-Ausführung
- Bürker: doppelte Netzteilung, Das Zählnetz zeigt 9 Großquadrate von je 1 mm². Sie werden für die Leukozytenzählung verwendet. Jedes Großquadrat ist durch Doppellinien (in 0,05 mm Abstand) in 16 Gruppenquadrate mit je 0,2 mm Seitenlänge unterteilt. Die Gruppenquadrate entsprechen größenmäßig denen der Neubauer-Zählkammern, jedoch ohne weitere Unterteilung. Sie werden für die Thrombo- und Erythrozytenzählung verwendet. Durch die Doppellinien ergeben sich Kleinstquadrate mit einer Fläche von 0,0025 mm².
- Bürker-Türk: doppelte Netzteilung (Kombination der Systeme Bürker und Thoma). Das Zählnetz zeigt 9 Großquadrate von je 1 mm². Jedes Großquadrat ist in 16 Gruppenquadrate mit je 0,2 mm Seitenlänge unterteilt. Im mittleren Großquadrat ist jedes Gruppenquadrat in 16 Kleinstquadrate mit je 0,05 mm Seitenlänge (= 0,0025 mm²) geteilt.
- Fuchs-Rosenthal: doppelte Netzteilung. Das Zählnetz unterscheidet sich von den Kammer-systemen, wie sie für die Blutzellenzählung üblich sind, durch seinen großen Flächeninhalt von 16 mm². Das Zählnetz zeigt 16 Großquadrate von je 1 mm². Jedes Großquadrat ist in 16 Kleinstquadrate mit je 0,25 mm Seitenlänge und einer Fläche von 0,0625 mm² unterteilt. Diese Zählkammer wird sehr häufig eingesetzt, u. a. für die Zellzählung im Liquor (Lumbalflüssigkeit).
- Jessen in Standard- und Bright-Lined-Ausführung.
- Lemaur in Standard- und Bright-Lined-Ausführung.
- Malassez: doppelte Netzteilung. Das Zählnetz ist rechteckig und bedeckt 5 mm². Die großen Rechtecke haben eine Fläche von 0,25 mm × 0,20 mm = 0,05 mm². Sie sind jeweils in 20 Kleinstquadrate mit einer Fläche von je 0,0025 mm² unterteilt. Diese Zählkammer wird u. a. für die Zell-Zählung im Liquor (Lumbalflüssigkeit) oder zur Zählung von Nematoden eingesetzt.
- McMaster mit 3 Feldern, Größe ca. 127 mm × 26 mm, Tiefe ca. 1,5 mm, zur Zählung von Wurmeiern.
- Nageotte: doppelte Netzteilung. Die Kammertiefe beträgt 0,5 mm. Die quadratische Grundfläche von 100 mm² ist in 40 Rechtecke mit einer Fläche von je 0,25 mm × 10 mm = 2,5 mm² unterteilt. Diese Zählkammer wird u. a. für die Zellzählung im Liquor (Lumbalflüssigkeit) oder zur Zählung von Nematoden eingesetzt.
- Petroff-Hausser mit Sondertiefe (Petroff) zum Zählen von Bakterien, Blutplättchen, Spermien etc., dunkellinig, zur Verwendung in Dunkelfeldmikroskopen. Die Tiefe der Zählkammer beträgt 0,02 mm mit einer Dicke von 1,5 mm.
- Schilling: Kreuznetz aus 3 × 3 Großquadraten, unterteilt in 4 × 4 Kleinstquadrate mit einer Fläche von je 0,0025 mm² und in 4 Rechtecke mit einer Fläche von 0,01 mm² und Einheitsnetz aus 9 Großquadraten, welche dem mittleren Quadrat des Kreuznetzes gleich sind.
Einzelnachweise
- Cell Counting with a Hemocytometer. Abgerufen am 15. Juli 2012.