Weerman-Abbau
Der Weerman-Abbau, seltener auch Weerman-Reaktion genannt, ist eine Namensreaktion der organischen Chemie. Im Jahre 1910 hat Rudolf Adrian Weerman das erste Mal von dieser Reaktion berichtet.[1] Im Wesentlichen handelt es sich hierbei um den Abbau von Amiden zu Aldehyden mit einem Kohlenstoff-Atom weniger.[2] Als Edukt kommen α-Hydroxy-substituierte Carbonsäureamide oder α,β-ungesättigte Carbonsäureamide zum Einsatz.
Abbau von α-Hydroxy-substituierten Carbonsäureamiden
Der Weerman-Abbau kann zum einen bei α-Hydroxy-substituierten Carbonsäureamiden durchgeführt werden. Hierzu gehören zum Beispiel Zucker.
Übersichtsreaktion
Beim Abbau von α-Hydroxy-substituierten Carbonsäureamiden verkürzt sich die Kohlenstoffkette um ein Kohlenstoffatom, es entsteht ein Aldehyd.[2]
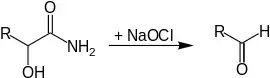
Die Carbonsäureamide reagieren mit Natriumhypochlorit über eine Hydrolyse zu Natriumcyanat und einem Aldehyd. Da die Reaktion bei Raumtemperatur nur sehr langsam abläuft wird das Reaktionsgemisch auf 60–65 °C erhitzt. Dadurch wird das Natriumhypochlorit innerhalb einer halben Stunde komplett verbraucht.
Mechanismus
Der Weerman-Abbau läuft vermutlich sehr ähnlich wie die Hofmann-Umlagerung ab, wie Zerong Wang in seinem Buch Comprehensive Organic Name Reactions und Reagents zeigt.[2]
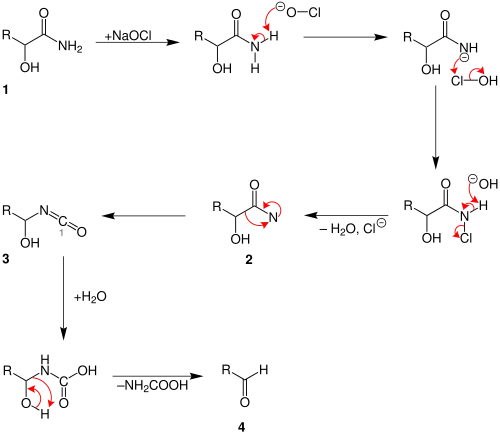
Am Anfang reagiert das Carbonsäureamid 1 mit dem Natriumhypochlorit. Nachdem Wasser und Chlorid-Ionen abgespalten wurden entsteht ein Amid (Nitren) mit zwei freien Elektronenpaaren am Stickstoff-Atom 2. Durch Umlagerung entsteht dann das Zwischenprodukt 3. Ab jetzt spielt die Hydroxy-Gruppe eine Rolle. Es findet zunächst eine Hydrolyse statt. Es lagert sich ein Wassermolekül an das Kohlenstoff-Atom mit der Ziffer 1. Dabei bildet sich eine Hydroxy-Gruppe. Durch Umlagerung spaltet sich ein Säureamid ab und es entsteht das gewünschte Aldehyd 4.
Abbau von α,β-ungesättigten Carbonsäureamiden
Zum Anderen funktioniert der Weerman-Abbau auch bei α,β-ungesättigten Carbonsäureamiden, wie zum Beispiel dem Acrylamid.
Übersichtsreaktion
Auch bei den α,β-ungesättigten Carbonsäureamiden verkürzt sich das Aldehyd um ein Kohlenstoff-Atom.[2]
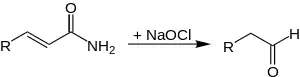
Bei dieser Reaktion muss zusätzlich Methanol zum Reaktionsgemisch gefügt werden. Somit läuft anstatt eine Hydrolyse eine Protolyse ab. Dabei entstehen dann Ethenyl-Urethane. Auch diese Reaktion wird bei 60–65 °C ablaufen gelassen, um die Reaktionsgeschwindigkeit zu erhöhen.
Mechanismus
Der Weerman-Abbau läuft vermutlich sehr ähnlich wie der Hofmann-Abbau ab, wie Zerong Wang in seinem Buch Comprehensive Organic Name Reactions und Reagents zeigt.[2]

Am Anfang reagiert das Carbonsäureamid 1 mit dem Natriumhypochlorit. Nachdem Wasser und Chlorid-Ionen abgespalten wurden entsteht ein Amid mit zwei freien Elektronenpaaren am Stickstoff-Atom 2. Durch Umlagerung entsteht dann das Zwischenprodukt 3. Ab jetzt spielt die α,β-ungesättigte Bindung und das Methanol eine Rolle. Ab hier kann der Mechanismus unterschiedlich ablaufen. Je nachdem, wie viele Methanol-Moleküle an die ungesättigten Bindungen angreifen. Im oberen Mechanismus greift das Methanol an beide ungesättigten Bindungen an. Und es bildet sich so das Zwischenprodukt 4. Danach spalten sich Kohlenstoffdioxid, Wasser, Ammonium-Ionen und Methanol über mehrere Schritte ab. Zusätzlich läuft eine Protolyse ab. So entsteht das Endprodukt 5, ein Aldehyd.
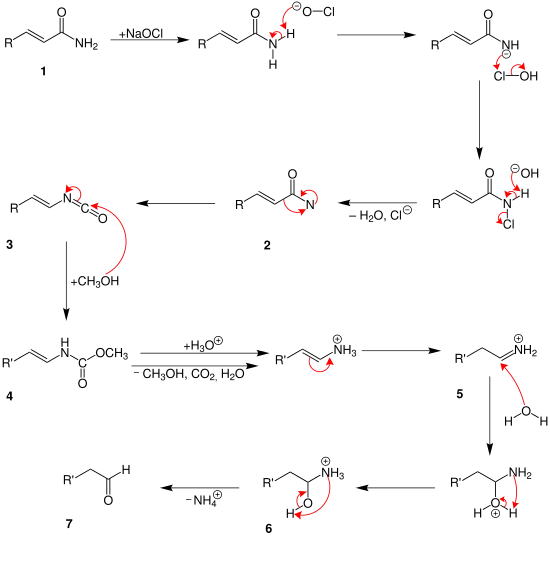
Bis zum Zwischenprodukt 3 läuft die Reaktion hier genau gleich ab. Danach lagert sich allerdings nur ein Methanol-Molekül an 4. Durch eine Protolyse spaltet sich dann nur Wasser, Methanol und Kohlenstoffdioxid ab. Es entsteht ein Kohlenwasserstoff mit einer Ammonium-Gruppe. Durch erneute Umlagerung entsteht ein anderes Ammonium-Ion 5. Dieses wird nun hydrolysiert. Dabei entsteht eine Hydroxy-Gruppe 6. Durch Abspaltung des Ammonium-Ions entsteht dann das Endprodukt 7, ein Aldehyd.
Anwendung
Der Abbau wurde vor allem dazu verwendet schwer synthetisierbare Aldehyde herzustellen, besonders um Aldonsäureamide zu Aldosen abzubauen.[3][4] Hier als Beispiel der allgemeine Abbau von D-Gluconamid zu D-Arabinose:[5]
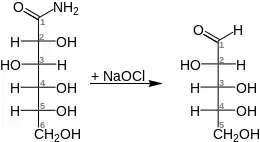
Außerdem konnte mit dem sogenannten Weerman-Test herausgefunden werden, ob sich eine Hydroxygruppe neben der Amidogruppe befindet. Allerdings werden bei dieser Reaktion auch Aldehydgruppen angegriffen, weshalb die Ausbeute immer sehr gering war. Hierbei kommt es dann vermehrt zu Polymerisationsreaktionen. Zusätzlich wird die Rückreaktion oft auch begünstigt. Eine relativ gute Ausbeute gelingt durch das verwenden von Urethanen. Der Weerman-Abbau besitzt nur noch chemiehistorische Bedeutung und wird heutzutage aufgrund zu geringer Ausbeuten und großtechnisch betriebener alternativer Aldehyhsynthesen (z. B. Hydroformylierung) nicht mehr verwendet.
Einzelnachweise
- R. A. Weerman: Sur une synthèse d'aldéhydes et de l'indol. In: Rec. Trav. Chim. Pays-Bas Belg. Band 29, 1910, S. 18–21, doi:10.1002/recl.19100290104.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, New Jersey 2009, ISBN 978-0-471-70450-8, S. 2946–2950.
- M. Windholz: The Merck Index. Merck&Co., Rakway 1976, ISBN 0-911910-26-3, S. ONR-92.
- R. A. Weerman: L'action de l'hypochlorite de sodium sur les amides d'α-hydroxy-acides et de polyhydroxy-acides, ayant un groupe hydroxyle à la place α. Nouvelle méthode de dégradation des sucres. In: Rec. Trav. Chim. Pays-Bas Belg. Band 37, 1918, S. 16–22, doi:10.1002/recl.19180370103.
- Louis F. Fieser, Mary Fieser: Lehrbuch der Organischen Chemie. Chemie, Weinheim 1957, S. 409–410.