Von-Richter-Reaktion
Die Von-Richter-Reaktion, auch Von-Richter-Umlagerung genannt, ist eine Namensreaktion der organischen Chemie. Die Reaktion wurde erstmals von Victor von Richter (1841–1891) im Jahre 1871 beschrieben.[1] Es handelt sich um die Synthese von aromatischen Säuren ausgehend von einem Nitrobenzolderivat.
Übersichtsreaktion
Es läuft eine nucleophile aromatische Substitution ab.[2] Die Reaktion wird hier schematisch am Beispiel der Umsetzung von p-Bromnitrobenzol zu m-Brombenzoesäure gezeigt:

Anstelle des Broms könnte auch Chlor als Substituent dienen. Bei der Reaktion wird der Aromat mit Kaliumcyanid in wässriger oder alkoholischer Lösung zur Reaktion gebracht. Als Produkt wird eine Carboxygruppe in ortho-Position zur vorherigen, nach der Reaktion nicht mehr vorhandenen, Nitrogruppe erhalten.[1][2][3] Bei der Reaktion werden meist nur sehr geringe Ausbeuten von weniger als 20 % erzielt.[4]
Reaktionsmechanismus
Der Reaktionsmechanismus der Von-Richter-Reaktion läuft anfangs ähnlich ab, wie der der Michael-Addition.[4] Statt 4-Bromnitrobenzol kann auch 4-Chlornitrobenzol als Startmaterial dienen.[2]

Zunächst greift das Cyanid in ortho-Position zur Nitrogruppe in 1 an, es entsteht 2. Im nächsten Schritt greift das negativ geladene Sauerstoff-Atom am benachbarten Kohlenstoff-Atom an und es bildet sich unter Rearomatisierung über eine Zwischenstufe die Fünfring-Zwischenstufe 3. Der Fünfring öffnet sich unter Bildung einer Carbonylgruppe in 4. Der nächste Schritt ist wieder eine Fünfring-Bildung, es entsteht 5. In diesem Fünfring bildet sich nach einer Wasserabspaltung eine Doppelbindung zwischen den beiden Stickstoff-Atomen aus, so resultiert 6. Danach wird Stickstoff abgespalten und der Ring öffnet sich zum Carboxylat 7. Zum Schluss wird 7 noch protoniert unter Bildung der 3-Halogenbenzoesäure [hier: 3-Brombenzoesäure (8)].
Anwendung
Die Anwendung der Von-Richter-Reaktion ist sehr beschränkt. Sie wird meist nur in organischen Synthesen verwendet.[4]
Geschichte
Victor von Richter erkannte, dass die Substitution der Carbonsäurefunktion in ortho-Stellung zur ehemals vorhandenen Nitrogruppe erfolgt und postulierte einen Reaktionsverlauf mit der Bildung eines Additionsprodukts des Aromaten mit Cyanwasserstoff, das nach Abspaltung von Salpetriger Säure zunächst ein substituiertes Benzonitril ergibt. Dieses sollte in Wasser zur entsprechenden Benzoesäure hydrolysieren. Das Benzonitrilzwischenprodukt konnte allerdings nicht nachgewiesen werden.
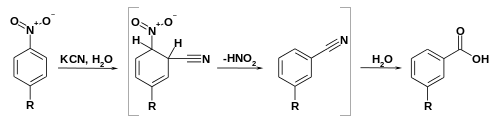
J. F. Bunnett führte in den 1950er-Jahren umfangreiche Untersuchungen zur Von-Richter-Reaktion durch.[5][6][7] Um das Fehlen des Benzonitrilzwischenprodukt zu erklären, entwickelte er 1958 einen Reaktionsmechanismus, der über zyklische Intermediate verläuft.[8] Als letzter Schritt sollte aus einem Acylnitrit unter Abspaltung Salpetriger Säure die Benzoesäure entstehen.
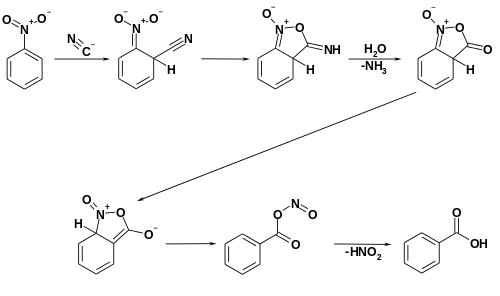
Im Jahr 1960 stellte M. Rosenblum fest, dass die Nebenprodukte Ammoniak und Salpetrige Säure nicht nachweisbar sind und dass stattdessen Stickstoff entsteht.[9][3]
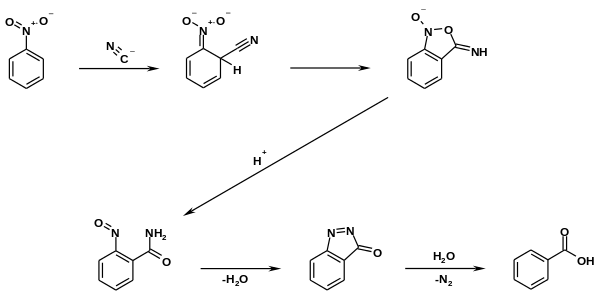
Allerdings ist aller Stickstoff weiter zu Ammoniak umgewandelt worden.[10]
Einzelnachweise
- V. von Richter: Untersuchungen über die Constitution der Benzolderivate. In: Berichte der deutschen chemischen Gesellschaft. 4 (1871), S. 459–468, doi:10.1002/cber.187100401154.
- M. Smith, M. B. Smith, J. March: March's advanced organic chemistry: reactions, mechanisms, and structure. 6. Auflage. Wiley, 2007, ISBN 978-0-471-72091-1.
- R. A. Y. Jones: Physical and Mechanistic Organic Chemistry. (Cambridge Texts in Chemistry and Biochemistry). 1979.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, New Jersey 2009, ISBN 978-0-471-70450-8, S. 2911–2914.
- J. F. Bunnett, J. F. Cormack, F. C. McKay: The von Richter Reaction. In: J. Org. Chem. 15 (1950), S. 481–490, doi:10.1021/jo01149a007.
- J. F. Bunnett, M. M. Rauhut, D. Knutson, G. E Bussell.: Studies on the Conditions, Scope and Mechanism of the von Richter Reaction. In: J. Am. Chem. Soc. 76 (1954), S. 5755–5761, doi:10.1021/ja01651a039.
- J. F. Bunnett, M. M. Rauhut: The von Richter Reaction. III. Substituent Effects. In: J. Org. Chem. 21 (1956), S. 934–938, doi:10.1021/jo01115a004.
- J. F. Bunnett: Mechanism and reactivity in aromatic nucleophilic substitution reactions. In: Q. Rev. Chem. Soc. 12 (1958), S. 1–16, doi:10.1039/QR9581200001.
- M. Rosenblum: The Mechanism of the von Richter Reaction. In: J. Am. Chem. Soc. 82 (1960), S. 3796–3798, doi:10.1021/ja01499a090.
- J. March: Advanced Organic Chemisytry. John Wiley & Sons, Rakway 1985, ISBN 0-471-88841-9, S. 603–604.