Concanavalin A
Concanavalin A (kurz Con A) ist ein Protein aus der Jackbohne (Canavalia ensiformis) und gehört zur Gruppe der Lektine, da es Kohlenhydrate, insbesondere α-D-Glucose und ähnliche Zucker binden kann[1], ohne eine enzymatische Aktivität aufzuweisen.
| Concanavalin A (Canavalia ensiformis) | ||
|---|---|---|
| ||
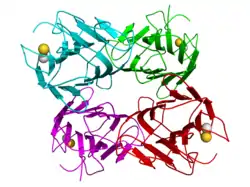
| Struktur des Concanavalin A | ||
|
Vorhandene Strukturdaten: s. UniProt | ||
| Masse/Länge Primärstruktur | 237 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Kofaktor | Ca2+, Mn2+ | |
| Bezeichner | ||
| Externe IDs | ||
Das Concanavalin-Monomer besteht aus 237 Aminosäuren und enthält strukturbildendes Mangan und Calcium. Die Anwesenheit dieser Metallionen bewirkt, dass Con A in der Lage ist, Kohlenhydrate zu binden. Bei einem neutralen pH-Wert (um 7) lagert es sich zu einem Tetramer zusammen, im sauren pH-Bereich zerfällt es zu einem Dimer. Da es vor allem in den Samen der Schwertbohne vorkommt und sehr stabil ist, dient es dieser Pflanze wahrscheinlich als Speicherprotein.
Verwendung
Durch die Fähigkeit bestimmte Kohlenhydrate zu binden, findet Con A breite Anwendung in der Biochemie, so verklumpt es beispielsweise Krebszellen, während gesunde Zellen nicht aggregiert werden. Auf Chromatographiesäulen aufgebrachtes (immobilisiertes Con A) dient zur Reinigung von Glykoproteinen und Kohlenhydraten.
In der immunologischen Forschung wird Con A als Mitogen eingesetzt, das T-Lymphozyten stimuliert; die Wirkung erfolgt vermutlich durch Aktivierung der T-Zellen über den CD3-Komplex. Es stimuliert jedoch auch B-Lymphozyten zur Proliferation.
Historisches
Concanavalin A war neben Urease eines der ersten Proteine, die um das Jahr 1930 gereinigt und kristallisiert werden konnten[2] (siehe auch: Proteinkristall); dafür erhielt James Batcheller Sumner 1946 den Nobelpreis für Chemie. Die Kristallstrukturanalyse mit der Bestimmung der Atompositionen des Proteins gelang erst ab 1975[3].
Literatur
- T. K. Chowdhury, A. K. Weiss (Hrsg.): Concanavalin A. Plenum Press, New York, 1975
Einzelnachweise
- Gail M. Bradbrook, Thomas Gleichmann, Stephen J. Harrop, Jarjis Habash, James Raftery: X-Ray and molecular dynamics studies of concanavalin-A glucoside and mannoside complexes Relating structure to thermodynamics of binding. In: Journal of the Chemical Society, Faraday Transactions. Band 94, Nr. 11, 1. Januar 1998, ISSN 1364-5455, S. 1603–1611, doi:10.1039/A800429C (rsc.org [abgerufen am 15. Januar 2022]).
- James B. Sumner, Nils Gralén, Inga-Britta Eriksson-Quensel: The Molecular Weights of Urease, Canavalin, Concanavalin A and Concanavalin B. In: Science. 29. April 1938, doi:10.1126/science.87.2261.395 (science.org [abgerufen am 15. Januar 2022]).
- A. Deacon, T. Gleichmann, A. J. Kalb (Gilboa), H. Price, J. Raftery: The structure of concanavalin A and its bound solvent determined with small-molecule accuracy at 0.94 [Aring ]resolution. In: Journal of the Chemical Society, Faraday Transactions. Band 93, Nr. 24, 1. Januar 1997, ISSN 1364-5455, S. 4305–4312, doi:10.1039/A704140C (rsc.org [abgerufen am 15. Januar 2022]).