Tropanole
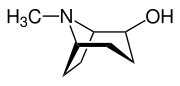
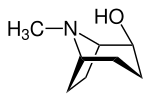
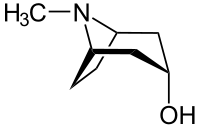
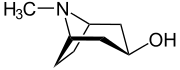
Die Tropanole leiten sich vom Tropan ab, wobei eine Hydroxysubstitution am C-1, C-2- bzw. am C-3-Atom vorliegt. Für das 2- und das 3-Tropanol können zwei Stereoisomere unterschieden werden. Bei den α-Tropanolen steht die Hydroxygruppe axial, bei dem β-Tropanolen äquatorial zum Ringsystem.
| Tropanole | |||||
| Name | (1R)-1-Tropanol | 2α-Tropanol | 2β-Tropanol | 3α-Tropanol | 3β-Tropanol |
| Andere Namen |
|
|
|
|
|
| Strukturformel | -1-Tropanol.svg.png.webp) |
 |
 |
 |
 |
| CAS-Nummer | 36127-54-5 | 36127-15-8 | 120-29-6 | 135-97-7 | |
| PubChem | 268139 | 54607705 | 8424 | ||
| Summenformel | C8H15NO | ||||
| Molare Masse | 141,21 g·mol−1 | ||||
| Schmelzpunkt | 47–48 °C oder 68–70 °C[1] | 46–48 °C[2] | −10 °C[3][4] | 63 °C[1] | 108–109 °C[1] |
| Siedepunkt | 94–95 °C[3][4] | 229 °C[1] | 240–241 °C[1] | ||
Eigenschaften
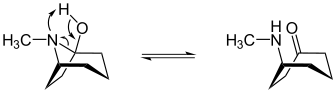
Das (1R)-1-Tropanol steht mit (R)-(Methylamino)cycloheptanon in einem tautomeren Gleichgewicht.[1]
Vorkommen

Tropanole und davon abgeleitete Tropanalkaloide kommen in mehreren Pflanzenfamilien, insbesondere in den Nachtschattengewächsen (Solanaceen) vor. Zum Beispiel im Bilsenkraut (Hyoscyamus niger), in der Tollkirsche (Atropa belladonna) und in verschiedenen Stechapfel-Arten (Datura spec.). Das (1R)-1-Tropanol ist in der Andenbeere (Physalis peruviana) zu finden.[1] Ebenso findet sich im Echten Löffelkraut (Cochlearia officinalis, Brassicaceae) das Cochlearin mit Tropin als Alkoholkomponente. Die anderen Familien sind: Proteaceae, Convolvulaceae, Euphorbiaceae, Rhizophoraceae und Erythroxylaceae. Es konnte nachgewiesen werden, dass die Entwicklung der zur Biosynthese nötigen Enzyme in Nachtschatten- und Rotholzgewächsen unabhängig voneinander stattfand.[5]
Einzelnachweise
- Eintrag zu 3α-Tropanol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Januar 2013.
- S. Sarel, E. Dykman: Hypoiodate-induced oxidative dimerization and functionalization of the tropane bicyclic system. In: Tetrahedron Lett. 17, 1976, S. 3725–3728, doi:10.1016/S0040-4039(00)93093-4.
- D. E. Ayer, G. Büchi, P. R. Warnhoff, D. M. White: The structure of dioscorine. In: Journal of the American Chemical Society 80, 1958, S. 6146–6146, doi:10.1021/ja01555a061.
- W. A. M. Davies et al.: 703. An alkaloid of Dioscorea hispida, Dennstedt. Part VI. Some investigations on the synthesis of tropan-2-one. In: Journal of the Chemical Society. 1960, S. 3504–3512, doi:10.1039/JR9600003504.
- J. Jirschitzka, G. W. Schmidt et al.: Plant tropane alkaloid biosynthesis evolved independently in the Solanaceae and Erythroxylaceae. In: Proceedings of the National Academy of Sciences of the United States of America. Band 109, Nummer 26, Juni 2012, S. 10304–10309. doi:10.1073/pnas.1200473109. PMID 22665766. PMC 3387132 (freier Volltext).