Triphenylzinnhydrid
Triphenylzinnhydrid ist eine chemische Verbindung aus der Gruppe der zinnorganischen Verbindungen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
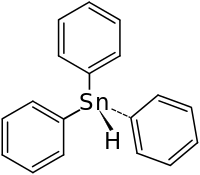 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Triphenylzinnhydrid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C18H16Sn | ||||||||||||||||||
| Kurzbeschreibung |
leicht gelblicher Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 351,03 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt |
28 °C[2] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Brechungsindex |
1,6327 (28 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Triphenylzinnhydrid kann durch Hydrierung von Triphenylzinnchlorid mit einem Reduktionsmittel, wie Lithiumaluminiumhydrid[3][4] oder Natriumborhydrid[1] hergestellt werden:
Eigenschaften
Triphenylzinnhydrid kann an einem dunkel, kühlen Ort unter einer Stickstoffatmosphäre einige Wochen gelagert werden. Bei Luftkontakt oder wenn es dem Licht ausgesetzt wird, zersetzt es sich unter Bildung von Tetraphenylzinn[4] oder Hexaphenyldistannan.[5]
Physikalische Eigenschaften
Im 1H-NMR-Spektrum findet man für das direkt an das Zinnatom gebundene Wasserstoffatom eine chemische Verschiebung von 409,6 Hz (bei 60 MHz Arbeitsfrequenz).[3] Im 13C-NMR zeigt Triphenylzinnhydrid folgende Signale:[6]
| Sn–C1– | –C2 | –C3 | –C4 | |
|---|---|---|---|---|
| ppm | 137,3 | 137,7 | 129,0 | 129,3 |
| J(13C–119Sn) | 534 | 41,4 | 53,0 | 11,4 |
Im 119Sn–NMR liefert es ein Signal bei −163 ppm. Der Zinn-Kohlenstoffabstand in Kristall liegt bei 2,15 Å.[6]
Verwendung
Im Labor kann Triphenylzinnhydrid zur Enthalogenierung von halogenierten Alkenen verwendet werden.[8]
Biologische Bedeutung
Wie andere Triphenylzinn-Verbindungen ist auch Triphenylzinnhydrid ein hochwirksames Biozid und wurde daher in der Vergangenheit in Antifouling-Farben und als Fungizid in der Landwirtschaft eingesetzt.
Sicherheitshinweise
Wie viele zinnorganische Verbindungen ist auch Triphenylzinnhydrid als giftig eingestuft. Es hat einen Flammpunkt von 113 °C.[2]
Nachweis
Organozinnhydride lassen sich im Infrarotspektrum einfach an einer ausgeprägten Sn-H-Bande im Bereich von 1800 bis 1880 cm−1 identifizieren.[1]
Literatur
- Dietrich Klingmüller, Burkard Watermann (Hrsg.): TBT - Zinnorganische Verbindungen - eine wissenschaftliche Bestandsaufnahme. (PDF; 2,0 MB) Umweltbundesamt Berlin, März 2003, ISSN 0722-186X
Einzelnachweise
- Ernest R. Birnbaum and Paul H. Javora: Organotin hydrides - B. Triphenyltin hydride (Hydridotriphenyltin). In: Robert W. Parry (Hrsg.): Inorganic Syntheses. Band 12. McGraw-Hill Book Company, Inc., 1970, ISBN 07-048517-8 (defekt), S. 45–57 (englisch).
- Datenblatt Triphenyltin hydride bei Sigma-Aldrich, abgerufen am 12. Juli 2015 (PDF).
- Eberhard Amberger, Heinz P. Fritz, Cornelius G. Kreiter, Maria-Regina Kula: Spektroskopische Untersuchungen an organometallischen Verbindungen, XXV. Protonenmagnetische Resonanzspektren von Triphenylstannan, Diphenylstannan und Monophenylstannan. In: Chemische Berichte. Band 96, Nr. 12, Dezember 1963, S. 3270–3274, doi:10.1002/cber.19630961224.
- G. J. M. van der Kerk, J. G. Noltes, J. G. A. Luijten: Investigations on organo-tin compounds. VIII. preparation of some organo-tin hydrides. In: Journal of Applied Chemistry. Band 7, Nr. 7, Juli 1957, S. 366, doi:10.1002/jctb.5010070704.
- Bodo Heyn, Bernd Hipler, Günter Kreisel, Heike Schreer, Dirk Walther: Anorganische Synthesechemie Ein integriertes Praktikum. Springer-Verlag, 2013, ISBN 978-3-642-75914-7, S. 44 (eingeschränkte Vorschau in der Google-Buchsuche).
- Cathrin Zeppek, Johann Pichler, Ana Torvisco, Michaela Flock, Frank Uhlig: Aryltin chlorides and hydrides: Preparation, detailed NMR studies and DFT calculations. In: Journal of Organometallic Chemistry. Band 740, September 2013, S. 41–49, doi:10.1016/j.jorganchem.2013.03.012.
- W. P. Neumann, E. Heymann, F. Kleiner, H. Lind, H. Niermann, J. Pedain, K. Rübsamen, B. Schneider, R. Sommer: Die Hydrostannierung ungesättigter Verbindungen. In: Angewandte Chemie. Band 76, Nr. 20, 21. Oktober 1964, S. 849–859, doi:10.1002/ange.19640762003.
- Horst Fricke, Wolfgang Kirmse, Otto Klein, Peter Müller, Heidi Müller-Dolezal, Gerhard Schröder, Renate Stoltz, Hanna Söll: Houben-Weyl Methods of Organic Chemistry Vol. V/1b, 4th Edition: Alkenes, Cycloalkenes, Arylalkenes. Georg Thieme Verlag, 2014, ISBN 978-3-13-179934-0, S. 624 ff. (eingeschränkte Vorschau in der Google-Buchsuche).

