Trifluridin
Trifluridin (abgekürzt TFT oder FTD[2]; als Kombinationspräparat mit Tipiracil Lonsurf; Hersteller Servier) ist ein Arzneistoff aus der Gruppe der Nukleosidanaloga.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
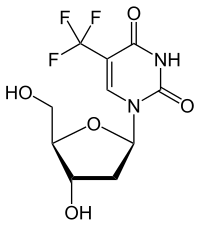 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trifluridin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H11F3N2O5 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
S01AD02 | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 296,2 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Die Verbindung wurde 1970 vom US-Gesundheitsministerium patentiert und wird als Virostatikum verwendet.[3]
Die Kombination aus Trifluridin und Tipiracil im molaren Verhältnis 1:0,5 (vormals TAS-102) wird zur oralen Behandlung des metastasierten Kolorektalkarzinoms erwachsener Patienten nach diversen Vortherapien verwendet. In der EU ist sie seit April 2016 zugelassen.[4][5]
Anwendungsgebiete
Kolorektales Karzinom
Die Kombination aus Trifluridin und Tipiracil ist in der EU seit April 2016 zur Behandlung erwachsener Patienten mit metastasiertem kolorektalem Karzinom zugelassen, die bereits mit verfügbaren Therapien behandelt wurden oder die für diese nicht geeignet sind. Diese Therapien umfassen Fluorpyrimidin-, Oxaliplatin- und Irinotecan basierte Chemotherapien, Anti-VEGF- und Anti-EGF-Rezeptor-Substanzen.[4][5] Basis für die Zulassung war die RECOURSE-Studie, eine prospektiv randomisierte, Placebo kontrollierte Phase III Studie mit 800 Patienten.[6] Die Randomisierung erfolgte im Verhältnis Verum : Placebo 2 : 1, jeweils mit bestmöglicher Unterstützung (BSC = Best Supportive Care). Die Studie konnte einen statistisch signifikanten Vorteil im primären Endpunkt, dem Gesamtüberleben (OS = Overall Survival) zeigen. Unter dieser Behandlung überlebten Patienten im Verumarm durchschnittlich 7,1 Monate, im Placeboarm 5,3 Monate (p = 0,001[6]). Die durchschnittliche Zeit bis zur Krankheitsprogression (PFS = Progression Free Survival) war in der Kombination Trifluridin/Tipiracil zwei Monate, im Placeboarm 1,7 Monate.[6] Bis zur finalen Analyse des Primären Endpunkts (OS) war ein Crossover nicht zulässig.[6] Weitere klinische Studienendpunkte waren die Tumorgesamtansprechrate (Overall Response Rate, ORR) und die Krankheitskontrollrate (disease control rate, DCR).
Magenkarzinom
Seit dem 3. September 2019 ist Trifluridin in Kombination mit Tipiracil (Handelsname Lonsurf, Hersteller Servier) in Europa als Monotherapie auch für die Behandlung von erwachsenen Patienten mit metastasiertem Magenkarzinom (einschließlich Adenokarzinomen des gastroösophagealen Übergangs) zugelassen, die bereits mit mindestens zwei systemischen Therapieregimen für die fortgeschrittene Erkrankung behandelt worden sind. Die Zulassung basiert auf der randomisierten, doppelblinden Placebo-kontrollierten Phase-III-Studie TAGS[7], in der das Kombinationspräparat plus Best Supportive Care (BSC) versus Placebo plus BSC bei insgesamt 507 Patienten mit metastasiertem Magenkarzinom (einschließlich Adenokarzinom des gastroösophagealen Übergangs) im Verhältnis 2:1 untersucht wurde. Die Patienten hatten zuvor mindestens zwei systemische Therapieregime erhalten, die unter anderem Chemotherapien mit Fluorpyrimidin, Platin, Ramucirumab und entweder Taxan oder Irinotecan sowie bei Eignung zusätzlich eine gegen HER2 (Humaner Epidermaler Wachstumsfaktor-Rezeptor 2) gerichtete Therapie umfassten.
Trifluridin/Tipiracil plus BSC verbesserte signifikant das mediane Gesamtüberleben (OS), das 5,7 vs. 3,6 Monate in der Placebo-Gruppe betrug (1- und 2-seitige p-Werte: < 0,0003 bzw. < 0,0006). Ein signifikanter Überlebensvorteil unter Trifluridin/Tipiracil plus BSC wurde auch hinsichtlich des PFS beobachtet (2,0 vs. 1,8 Monate; 2-seitiger p-Wert: < 0,0001). Die mediane Zeit bis zur Verschlechterung des Eastern Cooperative Oncology Group (ECOG)-Performance-Status auf 2 oder höher war unter Trifluridin/Tipiracil signifikant länger als in der Placebogruppe (4,3 vs. 2,3 Monate; 2-seitiger p-Wert: 0,00053). Zudem war Trifluridin/Tipiracil gut verträglich. Die häufigsten unerwünschten Ereignisse vom Grad 3 oder mehr unter Trifluridin/Tipiracil waren Neutropenie (34 %) und Anämie (19 %). In der Placebogruppe traten abdominelle Schmerzen (9 %) und eine Verschlechterung des Allgemeinzustands (9 %) am häufigsten auf[7].
Wirkungsweise und Eigenschaften
.svg.png.webp)
TPI = Tipiracil, TF = Trifluridin, TF-Thy = Trifluorthymin, TP = Thymidinphosphorylase, TK = Thymidylatkinase, TS = Thymidilatsynthase, dUMP = Desoxyuridinmonophosphat, dTMP/dTDP/dTTP = Desoxythymidinmono/-di/-triphosphat, TF-MP/-DP/-TP = Trifluridinmono/-di/-triphosphat
TF wird intrazellulär durch das Enzym Thymidinkinase zum Monophosphat (TF-MP) und durch das Enzym Thymidylatkinase nachfolgend zum Di- (TF-DP) und Triphosphat (TF-TP) phosphoryliert. TF-TP wird als falscher Baustein in die DNS eingebaut. Aus diesem falschen Einbau resultieren lang andauernde DNS-Schäden und DNS-Strangbrüche.[8][9] Der präzise Mechanismus hierzu ist noch unklar.[9] TF-MP wiederum bindet kovalent an Thyrosin-146 im aktiven Zentrum des Enzyms Thymidilatsynthetase (TS, auch Thymidilat-Synthase) und inhibiert dessen Aktivität-[9] TS ist für die Konversion von Uracil-Nukleotiden in die Thymidin-Nukleotide zuständig und ist somit durch die Aufrechterhaltung ausreichender Menge an Thymidin für die DNS-Synthese von vitaler Bedeutung. Thymidin kommt nur in DNS aber nicht in RNS vor. Dort ist Uridin zu finden.
Adjuvante Wirkung von Tipiracil
Die TS-Hemmung kann nur aufrechterhalten werden, wenn wie bei einer Dauerinfusion, TF kontinuierlich nachgeliefert würde. Ansonsten erholt sich die TS schnell und der zytotoxische Effekt ist beendet. TF wird bei der Resorption aus dem Darm, in der Leber, der Milz und auch intrazellulär recht schnell durch das Enzym Thymidinphosphorylase (TP) inaktiviert.[9]
Analog zu Thymidin wird Trifluridin durch TP zu Trifluorthymin und 2-Desoxyribose-1-phosphat abgebaut. Diese Reaktion kann durch Hinzunahme des TP-Inhibitors Tipiracil effektiv unterbunden werden. Das Kombinationspräparat besteht aus dem nukleosidischen Thymidinanalogon Trifluridin (TF; Synonym: Trifluorthymidin, TFT) und dem Thymidinphosphorylaseinhibitor Tipiracil (TPI). Das molare Mengenverhältnis Trifluridin/Tipiracil ist 1 : 0,5 (exaktes Massenverhältnis: 1 : 0,471). Dadurch gelingt es die intrazelluläre Kinetik von TF wie eine Dauerinfusion zu simulieren. Trifluridin/Tipiracil (TAS-102, Handelsname Lonsurf) muss zweimal täglich eingenommen werden (s. u.).
Eine weitere Wirkqualität von Tipiracil sind antiangiogene Eigenschaften. Bei der Behandlung des Kolorektalkarzinoms und anderer Tumore werden Medikamente gegen die tumorbedingte Blutgefäßneubildung (Angiogenese) eingesetzt. Bereits in den 1990er Jahren wurde entdeckt, dass die TP proangiogene Eigenschaften hat bzw. dass sie identisch mit dem von Plättchen abgeleiteten, Endothelialzellwachstumsfaktor PD-ECGF ist (= Platelet-derived endothelial cell growth factor).[10] Spätere Untersuchungen haben das bestätigt.[9][11] Diese Eigenschaften könnten einerseits dazu beitragen, dass Trifluridin/Tipiracil bei den stark vorbehandelten Patienten noch wirken und die Entstehung einer Medikamentenresistenz verzögert oder verhindert wird. Ob die in der Kombination enthaltene Dosis von Tipiracil für eine signifikante Antiangiogenese bei Kolorektalkarzinompatienten ausreicht, kann aber nicht zwangsläufig abgeleitet werden.[9][11]
Vergleich Trifluridin und Fluorouracil (5-FU)
.svg.png.webp)
Trifluridin (TF) wird im Mausmodell stärker in die DNS inkorporiert als andere antitumorale Nukleoside. Nach oraler Verabreichung wird Trifluridin effektiver in die DNS eingebaut als nach kontinuierlicher Infusion bei gleichzeitig erhöhter antitumoraler Aktivität und besserer Verträglichkeit. In Kombination als TAS-102 akkumulierte TF graduell in der Tumor-DNS unabhängig von TPI. Im Vergleich zu 5-FU-Derivaten verzögerte TF/TPI signifikant das Tumorwachstum und verlängerte das Überleben im Mausversuch.[12]
Fluorouracil (5-FU) ist ein Antimetabolit aus der Gruppe der Pyrimidinanaloga und ähnelt dem Uracil (s. Abb.) Auch 5-FU ist nicht aktiv, sondern muss in die entsprechenden Ribo- und Desoxyribonukleoside (5-Fluorouridin, 5-Fluorodesoxyuridin) verstoffwechselt werden. Der Metabolit 5-FdUMP hemmt die Thymidilat-Synthase, wodurch die Umwandlung von Desoxyuridinmonophosphat (dUMP) zu Desoxythymidinmonophosphat (dTMP) blockiert und in der Folge die DNA-Synthese inhibiert wird. Mit Trifluridin liegt bereits das dem Thymidin ähnelnde Desoxynukleosid vor. Hier wurde die Methylgruppe durch Trifluorierung ersetzt, die das Enzym durch Bindung an das katalytische Zentrum hemmt. In präklinischen Studien wurden für Trifluridin/Tipiracil sowohl gegen 5-Fluorouracil (5-FU)-sensitive als auch gegen resistente kolorektale Tumorzelllinien getestet. Hierbei korrelierte die zytotoxische Aktivität von Trifluridin/Tipiracil in unterschiedlichen humanen Tumor-Xenotransplantaten stark mit der in die DNS eingebauten Menge von Trifluridin, was den DNA-Einbau als primären Wirkmechanismus nahelegt. Der antitumorale Effekt von TF wird somit prädominant durch den Falscheinbau in DNS bewirkt und weniger durch die TS-Hemmung.[12]
Nebenwirkungen
Die Kombination kann eine schwere Knochenmarkshemmung (Myelosuppression) mit einer Minderung verschiedener Blutbestandteile (Anämie, Neutropenie und Thrombozytopenie) verursachen. Eine Folge davon können schwere Infekte sein. Daher muss ein Gesamtblutbild vor dem Beginn der Therapie und zumindest vor jedem Behandlungszyklus erstellt werden. Weitere Nebenwirkungen ungeachtet der Schwere und der Häufigkeiten sind gemäß der europäischen Fachinformation: gastrointestinale Beschwerden wie Übelkeit, Durchfall (Diarrhö), Erbrechen, Bauchschmerzen, Entzündung der Mundschleimhaut (Stomatitis), Kraftlosigkeit/Müdigkeit (Asthenie/Fatigue), Fieber (Pyrexie), verminderter Appetit, Geschmacksstörung, Haarausfall.
Gegenanzeigen
Überempfindlichkeit gegen Trifluridin und/oder Tipiracil.
Pharmakokinetik
Resorption/Bioverfügbarkeit
Nach oraler Gabe von Trifluridin/Tipiracil wird mindestens 57 % / 27 %der verabreichten Menge resorbiert. Zeit bis zur maximalen Plasmakonzentration (tmax) von Trifluridin/Tipiracil ca. 2 bzw. 3 Stunden. Ausscheidung via Faeces: Trifluridin/Tipiracil 3 %/50 % Plasmaproteinbindung: Trifluridin/Tipiracil 96 %, 7 > 8 % Scheinbares Verteilungsvolumen (Vd/F) von Trifluridin/Tipiracil 21 l/333 l
Biotransformation und Elimination
Die Elimination von Trifluridin erfolgt hauptsächlich durch Umwandlung in seinen inaktiven Hauptmetaboliten 5-[Trifluormethyl]-uracil (TFMU) mittels TP im Urin. Weniger häufige Metabolite sind 5-Carboxyuracil und 5-Carboxy-2'-desoxyuridin und werden ebenso im Urin in geringer Menge oder Spuren nachgewiesen.
Eine Analyse zur Populationspharmakokinetik ergab keine klinisch relevanten Effekte von Alter, Geschlecht, ethnischer Zugehörigkeit auf die Pharmakokinetik von Trifluridin oder Tipiracil.
Wechselwirkungen
In vitro-Studien zeigten, dass weder Trifluridin noch Tipiracil und auch der inaktive Hauptmetabolit TMFU die Aktivität von menschlichen Cytochrom P450 (CYP)-Isoenzymen inhibieren. Eine induzierende Wirkung von Tipiracil auf humane CYP-Isoenzyme kann nicht ausgeschlossen werden. In vitro ist Trifluridin ein Substrat der Nukleosidtransporter CNT1, ENT1 und ENT2. Tipiracil ist ein Substrat des organischen Kationentransporter Polypeptids 2 (OCT2) und des SLC-Transporter MATE1 (Multidrug And Toxin Extrusion 1).
Bei der Anwendung von Arzneimitteln, die den humanen Thymidin-Kinase-Substraten angehören, z. B. bestimmte Virustatika, können diese Arzneimittel bei gleichzeitiger Anwendung mit Trifluridin/Tipiracil mit Trifluridin um die Aktivierung durch die Thymidin-Kinase konkurrieren und eine verminderte Wirksamkeit aufweisen. Sofern eine gleichzeitige antivirale Therapie unvermeidbar ist, sollten Thymidinkinase unabhängige Wirkstoffe zur Anwendung kommen.
Darreichungsformen
Das Fertigarzneimittel von Trifluridin/Tipiracil ist in den Dosisstärken 15 mg Trifluridin/6,14 mg Tipiracil und 20 mg Trifluridin/8,19 mg Tipiracil verfügbar.
Leitlinienempfehlungen
Gemäß der deutschen S3-Leitlinie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) sollte Trifluridin/Tipiracil bei Patienten mit kolorektalem Karzinom eingesetzt werden, wenn alle verfügbaren Chemo-/Antikörpertherapieoptionen ausgeschöpft oder für den Patienten nicht geeignet sind[13]. Von der European Society for Medical Oncology (ESMO) und dem National Comprehensive Cancer Network (NCCN) wird Trifluridin/Tipiracil als Drittlinientherapie beim fortgeschrittenen bzw. metastasierten kolorektalen Karzinom empfohlen[14][15], wobei die Wirkstoffkombination gemäß Empfehlungen des NCCN allein oder in Kombination mit Bevacizumab gegeben werden kann. Zudem wird Trifluridin/Tipiracil von den internationalen Leitlinien für die Drittlinientherapie bei Patienten mit Magenkarzinom empfohlen[16][17].
Nutzenbewertung nach § 35a SGB V
Im Nutzenbewertungsverfahren wurde für Trifluridin/Tipiracil (Handelsname: Lonsurf) vom Gemeinsamen Bundesausschuss (G-BA) am 1. Oktober 2020 ein Anhaltspunkt für einen geringen Zusatznutzen für die Wirkstoffkombination gegenüber Best Supportive Care für vorbehandelte Patienten mit metastasiertem kolorektalem Karzinom festgestellt[18]. Auch im Rahmen der Indikationserweiterung (metastasiertes Magenkarzinom, einschließlich Adenokarzinom des gastroösophagealen Übergangs) gibt es gemäß G-BA-Beschluss vom 2. April 2020 Hinweise auf einen geringen Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie[19].
Historisches
Trifluridin und 5-FU wurden zeitgleich in den 1960er Jahren in die Therapie eingeführt.[20] Bis zur Entwicklung der protrahierten Infusionen war 5-FU zwar extensiv eingesetzt, allerdings mit mäßigem Erfolg.[21] Trifluridin allein hätte wegen der o. g. kurzen Halbwertszeit alle 3 Stunden (auch nachts) i.v. gegeben werden müssen, bis eine Tagesdosis von 2,5 mg/kg erreicht wäre.[22] Vom Grundsatz her zeigten die Tests mit Trifluridin seinerzeit, dass die Substanz eine Antitumor-Aktivität besitzt. Die Entwicklung als Zytostatikum musste aber abgebrochen werden, da bei den erforderlichen Dosen die Toxizität zu groß war. Wegen seiner auch vorhandenen antiviralen Aktivität gegen Herpes simplex kam Trifluridin in verschiedenen Ländern in Form von Augentropfen auf den Markt. Als Virustatikum wird/wurde es eingesetzt zur Behandlung von durch Herpes Simplex-Viren ausgelöste Keratitiden.
Einzelnachweise
- Datenblatt Trifluorothymidine, ≥99% (HPLC) bei Sigma-Aldrich, abgerufen am 16. Juni 2016 (PDF).
- https://pubmed.ncbi.nlm.nih.gov/34406678, 20, September 2021.
- Eintrag zu Trifluridin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juni 2016.
- European Medicines Agency (EMA). Lonsurf: EPAR – Product Information. 2016. https://www.ema.europa.eu/en/documents/product-information/lonsurf-epar-product-information_de.pdf. Stand: Januar 2021; abgerufen am 1. Juni 2021
- EMA. Lonsurf – Summary of Opinion. 2016.
- Robert J. Mayer, Eric Van Cutsem, Alfredo Falcone, Takayuki Yoshino, Rocio Garcia-Carbonero, Nobuyuki Mizunuma, Kentaro Yamazaki, Yasuhiro Shimada, Josep Tabernero, Yoshito Komatsu, Alberto Sobrero, Eveline Boucher, Marc Peeters, Ben Tran, Heinz-Josef Lenz, Alberto Zaniboni, Howard Hochster, James M. Cleary, Hans Prenen, Fabio Benedetti, Hirokazu Mizuguchi, Lukas Makris, Masanobu Ito, Atsushi Ohtsu: Randomized Trial of TAS-102 for Refractory Metastatic Colorectal Cancer. In: New England Journal of Medicine. Band 372, Nr. 20, Mai 2015, S. 1909–1919, doi:10.1056/NEJMoa1414325, PMID 25970050.
- Shitara K, Doi T, Dvorkin M, et al.: Trifluridine/tipiracil versus placebo in patients with heavily pretreated metastatic gastric cancer (TAGS): a randomised, double-blind, placebo-controlled, phase 3 trial. In: The Lancet Oncology. Band 19, Nr. 11, Nov 2018, S. 1437–1448, doi: 10.1016/S1470-2045(18)30739-3.
- Irene V. Bijnsdorp, Godefridus J. Peters, Olaf H. Temmink, Masakazu Fukushima, Frank A. Kruyt: Differential activation of cell death and autophagy results in an increased cytotoxic potential for trifluorothymidine compared to 5-fluorouracil in colon cancer cells. In: International Journal of Cancer. Band 126, Nr. 10, Mai 2010, S. 2457–2468, doi:10.1002/ijc.24943.
- Olaf H. Temmink, Tomohiro Emura, Michiel De Bruin, Masakazu Fukushima, Godefridus J. Peters: Therapeutic potential of the dual-targeted TAS-102 formulation in the treatment of gastrointestinal malignancies. In: Cancer Science. Band 98, Nr. 6, Juni 2007, S. 779–789, doi:10.1111/j.1349-7006.2007.00477.x.
- Kensuke Usuki, Jan Saras, Johannes Waltenberger, Kohei Miyazono, Glenn Pierce, Arlen Thomason, Carl-Henrik Heldin: Platelet-derived endothelial cell growth factor has thymidine phosphorylase activity. In: Biochemical and Biophysical Research Communications. Band 184, Nr. 3, Mai 1992, S. 1311–1316, doi:10.1016/S0006-291X(05)80025-7.
- Godefridus J. Petersemail, Irene V. Bijnsdorp: TAS-102: more than an antimetabolite. In: The Lancet Oncology. Band 13, Nr. 12, Dezember 2012, S. e518-e519, doi:10.1016/S1470-2045(12)70426-6.
- Nozomu Tanaka, Kazuki Sakamoto, Hiroyuki Okabe, Akio Fujioka, Keisuke Yamamura, Fumio Nakagawa, Hideki Nagase, Tatsushi Yokogawa, Kei Oguchi, Keiji Ishida, Akiko Osada, Hiromi Kazuno, Yukari Yamada, Kenichi Matsuo: Repeated oral dosing of TAS-102 confers high trifluridine incorporation into DNA and sustained antitumor activity in mouse models. In: Oncology Reports. Band 32, Nr. 6, 2014, S. 2319–2326, doi:10.3892/or.2014.3487.
- AWMF. S3-Leitlinie Kolorektales Karzinom. https://www.awmf.org/uploads/tx_szleitlinien/021-007OLl_S3_Kolorektales-Karzinom-KRK_2019-01.pdf; abgerufen am 16. März 2021
- Van Cutsem E, Cervantes A, Adam R, et al. ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. In: Annals Oncology. Band: 27, Nr. 8, Aug 2016, S. 1386–422, 10.1093/annonc/mdw235.
- NCCN Clinical Practice guidelines Oncology (NCCN Guidelines®) – colon cancer. https://www.nccn.org/professionals/physician_gls/default.aspx; abgerufen am 18. März 2021
- Smyth EC, Verheij M, Allum W, et al. eUpdate – gastric cancer treatment recommendations. https://www.esmo.org/guidelines/gastrointestinal-cancers/gastric-cancer/eupdate-gastric-cancer-treatment-recommendations2; Stand: November 2019; abgerufen am 16. März 2021
- NCCN Clinical Practice guidelines Oncology (NCCN Guidelines®) – gastric cancer. https://www.nccn.org/professionals/physician_gls/default.aspx; abgerufen am 16. März 2021
- G-BA. Nutzenbewertungsverfahren zum Wirkstoff Trifluridin/Tipiracil (Neubewertung nach Fristablauf: Kolorektalkarzinom, vorbehandelte Patienten). https://www.g-ba.de/bewertungsverfahren/nutzenbewertung/541/#beschluesse; abgerufen am 16. März 2021
- G-BA. Nutzenbewertungsverfahren zum Wirkstoff Trifluridin/Tipiracil (neues Anwendungsgebiet: metastasiertes Magenkarzinom, vorbehandelte Patienten). https://www.g-ba.de/bewertungsverfahren/nutzenbewertung/504/#zweckmaessige-vergleichstherapie; abgerufen am 16. März 2021
- Charles. Heidelberger, David. Parsons, David C. Remy: Syntheses of 5-Trifluoromethyluracil and 5-Trifluoromethyl-2″-Deoxyuridine. In: Journal of the American Chemical Society. Band 84, Nr. 18, 1962, S. 3597–3598, doi:10.1021/ja00877a046.
- Paulo M. Hoff, Jim Cassidy, Hans-Joachim Schmoll: The Evolution of Fluoropyrimidine Therapy: From Intravenous to Oral. In: The Oncologist. Band 6, Supplement 4, 2001, S. 3–11, doi:10.1634/theoncologist.6-suppl_4-3.
- David S. Hong, James L. Abbruzzese, Karla Bogaard, Yvonne Lassere, Masakazu Fukushima, Akira Mita, Keizo Kuwata, Paulo M. Hoff: Phase I study to determine the safety and pharmacokinetics of oral administration of TAS-102 in patients with solid tumors. In: Cancer. Band 107, Nr. 6, 2006, S. 1383–1390, doi:10.1002/cncr.22125.