Oppenauer-Oxidation
Die Oppenauer-Oxidation ist eine Namensreaktion der organischen Chemie. Sie wurde nach ihrem Entdecker Rupert Viktor Oppenauer (1910–1969) benannt.[1] Die Oppenauer-Oxidation ist eine Methode zur Synthese von Ketonen aus den entsprechenden sekundären Alkoholen.
Sie ist die Umkehrung der Meerwein-Ponndorf-Verley-Reduktion.[2] Der Alkohol wird mit Aluminiumalkoholat in einem Überschuss an Aceton oxidiert. Hierdurch liegt das Gleichgewicht auf der rechten Seite.[3]
 Übersichtsreaktion der Oppenauer-Oxidation; R entspricht einer tert-Butylgruppe[4] oder einer iso-Propylgruppe,[3] R1 und R2 bezeichnen organische Reste, wie z. B. Alkylreste.
Übersichtsreaktion der Oppenauer-Oxidation; R entspricht einer tert-Butylgruppe[4] oder einer iso-Propylgruppe,[3] R1 und R2 bezeichnen organische Reste, wie z. B. Alkylreste.
Seit dem Aufkommen der auf Chromaten (z. B. PCC) oder Dimethylsulfoxid basierenden Oxidationsmethoden (z. B. Swern-Oxidation) ist die Oppenauer-Oxidation von verminderter präparativer Bedeutung. Aufgrund der basischen Reaktionsbedingungen ist sie jedoch für die Oxidation säureempfindlicher Substrate geeignet. Eine Variante, die Trichloracetaldehyd und Aluminiumoxid verwendet, erlaubt es selektiv sekundäre neben unveränderten primären Alkoholen zu oxidieren.
Mechanismus
In diesem Mechanismus steht der Rest R wieder für eine tert-Butylgruppe.
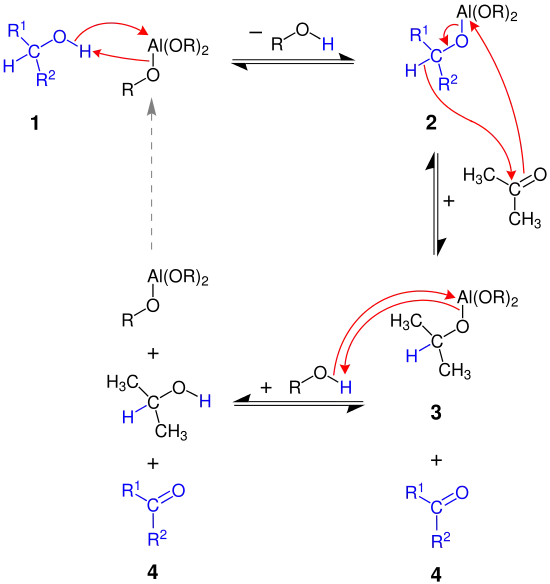 Mechanismus der Oppenauer-Oxidation;[5] R1 und R2 bezeichnen organische Reste
Mechanismus der Oppenauer-Oxidation;[5] R1 und R2 bezeichnen organische Reste
Der Mechanismus beschreibt wie mit Hilfe der Oppenauer-Oxidation ein sekundärer Alkohol 1 zu einem Keton 4 oxidiert wird. Zunächst reagiert der Alkohol mit dem katalytischen Aluminiumalkoholat zu Molekül 2. Das im Überschuss zugegebene Aceton wirkt dann als Hydridakzeptor und somit als Oxidationsmittel für den sekundären Alkohol. Die Reaktion des Aluminiumalkoholats 2 mit Aceton zu dem gewünschten Keton 4 und Molekül 3 verläuft über einen sechsgliedrigen Übergangszustand:[6][7]
 Sechsgliedriger Übergangszustand;[8] Oxidation des Alkohols (blau) zum Keton
Sechsgliedriger Übergangszustand;[8] Oxidation des Alkohols (blau) zum Keton
Abschließend reagiert Molekül 3 mit dem zu Beginn abgespaltenen Alkohol zu iso-Propanol und dem Aluminiumalkoholat, welches nun erneut als Katalysator zur Verfügung steht.
Literatur
- Eberhard Breitmaier, Günther Jung: Organische Chemie. 5. Auflage, Thieme, Stuttgart 2005, ISBN 3-13-541505-8. (eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
- R. V. Oppenauer: Eine Methode der Dehydrierung von Sekundären Alkoholen zu Ketonen. I. Zur Herstellung von Sterinketonen und Sexualhormonen. In: Recueil des Travaux Chimiques des Pays-Bas. 56, 1937, S. 137, doi:10.1002/recl.19370560206.
- The Merck Index: An Encyclopedia of Chemicals, Drugs and Biologicals, 14. Auflage, Merck, Whitehouse Station, NJ, USA 2006, S. ONR-68, ISBN 978-0-911910-00-1.
- K. Schwetlick et al.: Organikum, 23. Auflage, Wiley-VCH, Weinheim 2009, S. 578, ISBN 978-3-527-32292-3.
- H. Höver: Reaktionsmechanismen der Organischen Chemie, Verlag Chemie, Weinheim, John Wiley & Sons, Frankfurt am Main 1973, S. 136, ISBN 3-527-25442-0.
- nach: E. J. Corey, K. C. Nicolaou: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier, Inc, 2005, ISBN 978-7-03-019190-8.
- U. Lüning: Organische Reaktionen, 2. Auflage, Elsevier Spektrum Akademischer Verlag, München 2007, S. 142, ISBN 978-3-8274-1834-0.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents, Vol. 2, John Wiley & Sons, 2009, S. 2089, ISBN 978-0-471-70450-8.
- Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie, Springer-Verlag, Wien-New York 1972, S. 200, ISBN 3-211-81060-9.