Tigecyclin
Tigecyclin ist ein halbsynthetisch hergestelltes Antibiotikum und der erste Vertreter aus der Klasse der Glycylcycline. Dies sind Derivate der Tetracycline, die in 9-Position am D-Ring eine Glycylamidogruppe tragen. Tigecyclin umgeht zwei wichtige Resistenzmechanismen: die Effluxpumpe und ribosomale Schutzmechanismen. Das sehr breite Wirkungsspektrum umfasst grampositive, gramnegative, atypische und multiresistente Keime. Unter dem Handelsnamen Tygacil wurde Tigecyclin im November 2007 in Deutschland zur parenteralen Behandlung schwerer Infektionen zugelassen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
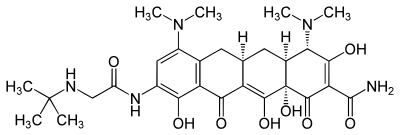 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Tigecyclin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C29H39N5O8 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
J01AA12 | |||||||||||||||||||||
| Wirkstoffklasse |
Tetracyclin-Antibiotikum, Glycylcyclin | |||||||||||||||||||||
| Wirkmechanismus |
Hemmung der bakteriellen Proteinbiosynthese an deren Ribosomen | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 585,65 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Anwendungsgebiete
Tigecyclin ist angezeigt bei Erwachsenen und Kindern ab 8 Jahren zur Behandlung von:
- komplizierten Haut- und Weichteilinfektionen (außer bei Infektionen des diabetischen Fußes),
- komplizierten intraabdominellen Infektionen, wenn andere alternative Antibiotika nicht geeignet sind.[3]
Nicht angezeigt ist Tigecyclin bei Infektionen mit Pseudomonas aeruginosa. Tigecyclin ist ausdrücklich nur zur Behandlung von komplizierten Haut- und Weichgewebsinfektionen und komplizierten intraabdominellen Infektionen zugelassen.
Tigecyclin hatte in klinischen Studien eine erhöhte Letalität gezeigt;[4] insbesondere scheint der Krankheitsverlauf bei Patienten ungünstiger zu sein, bei denen es unter der Therapie mit Tigecyclin zu einer Superinfektion kommt – vor allem im Fall einer nosokomialen Pneumonie. Patienten sollten engmaschig hinsichtlich der Entwicklung einer Superinfektion überwacht werden.
Falls nach Beginn der Therapie festgestellt wird, dass der Infektionsfokus nicht den zugelassenen Indikationen entspricht, wird eine alternative antibakterielle Therapie empfohlen.[4]
Wirkmechanismus
Tigecyclin wirkt grundsätzlich wie die klassischen Tetracycline, bindet aber mit fünffach höherer Affinität an Ribosomen und bewirkt somit, dass Protektionsproteine unwirksam werden.
Tigecyclin wird nicht von der Effluxpumpe aus der Zielzelle heraustransportiert und wirkt somit auch gegen Erreger, die gegen andere Wirkstoffe bereits resistent sind.
Metabolismus
Weniger als 20 % werden metabolisiert, die Halbwertzeit beträgt 42 Stunden. 60 % werden über Galle und Faeces, 33 % über den Urin ausgeschieden.
Nebenwirkungen
Für Kinder und Jugendliche unter 18 Jahren existieren noch keine Studien; erste Hinweise deuten eine verzögerte Knochenbildung an. Übelkeit und Erbrechen treten signifikant häufiger auf als in Vergleichsgruppen. Die Nebenwirkung ist dosisabhängig, deshalb wird empfohlen, die Tagesdosis auf zwei Gaben zu verteilen. Bei Tigecyclin tritt eine erhöhte Letalität auf. Dies trifft insbesondere auf die Behandlung der Lungenentzündung zu; so traten unter Tigecyclin bei der Behandlung von im Krankenhaus erworbenen Pneumonien 1,9 % mehr Todesfälle als unter Vergleichssubstanzen auf (14,1 vs. 12,2 %), in der Untergruppe der beatmungsassoziierten Pneumonien waren es sogar 6,8 % mehr Todesfälle (19,1 vs. 12,3 %).[5]
Wechselwirkung
Tigecyclin wird nicht über das Cytochrom-P450-System metabolisiert, was sich positiv auf mögliche Wechselwirkungen auswirkt. In vitro konnte kein Antagonismus zu anderen Antibiotikagruppen festgestellt werden. Bei gleichzeitiger Gabe von Warfarin müssen die Blutgerinnungsparameter kontrolliert werden. Die Wirksamkeit oraler Kontrazeptiva kann beeinträchtigt sein.
Applikation
Tigecyclin wird intravenös verabreicht. Man beginnt mit einer Initialdosis von 100 mg, anschließend 50 mg alle 12 Stunden.
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 4S,4aS,5aR,12aS)-9- [2-(tert-butylamino)acetamido] -4,7-bis (dimethylamino) -1,4,4a,5,5a,6,11, 12a-octahydro-3,10,12, 2a-tetrahydroxy-1, 11-dioxo-2-naphthacenecarboxamide (hydrochloride) im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 12. Juli 2020.
- Accessdata FDA: FDA Tygacil (tigecycline) i.v. injection label (PDF; 325 kB).
- fachinfo.de: Tygacil (PDF).
- Rote-Hand-Brief der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ).
- FDA: FDA Drug Safety Communication: Increased risk of death with Tygacil (tigecycline) compared to other antibiotics used to treat similar infections.