Thiophosphoryltrichlorid
Thiophosphoryltrichlorid ist eine anorganische chemische Verbindung aus der Gruppe der Phosphorhalogenide und Schwefelverbindungen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
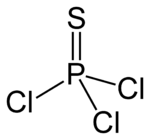 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Thiophosphoryltrichlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | PSCl3 | ||||||||||||||||||
| Kurzbeschreibung |
flüchtige, farblose Flüssigkeit mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 169,40 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,635–1,668 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
−35 °C[1] | ||||||||||||||||||
| Siedepunkt |
125 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Thiophosphoryltrichlorid kann durch verschiedene Reaktionen aus Phosphortrichlorid dargestellt werden. Die häufigste praktische Synthese, welche bei der industriellen Herstellung verwendet wird, ist die Reaktion von Phosphortrichlorid mit überschüssigem Schwefel bei 180 °C.[3]
Alternativ ist die Herstellung durch Reaktion von Phosphorpentasulfid und Phosphorpentachlorid mit einer Ausbeute von etwa 70 % möglich.[4]
Eigenschaften
Thiophosphoryltrichlorid ist eine flüchtige, farblose Flüssigkeit mit stechendem Geruch. Sie ist chemisch instabil bei erhöhter Temperatur und hydrolysiert in Wasser langsam unter Bildung von Orthophosphorsäure, Salzsäure und Schwefelwasserstoff. Die Verbindung ist unter anderem gut löslich in Benzol, Tetrachlorkohlenstoff, Schwefelkohlenstoff und Chloroform.[5]
Verwendung
Thiophosphoryltrichlorid wird zur Herstellung von organischen Thiophosphorverbindungen (wie Insektiziden z. B. Parathion) und Thioamiden verwendet.[6]
Sicherheitshinweise
Die bei der Hydrolyse von Thiophosphoryltrichlorid (siehe oben) entstehenden Gase können sich bei Erwärmung an Luft entzünden oder explodieren.[1]
Einzelnachweise
- Eintrag zu Thiophosphoryltrichlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Februar 2021. (JavaScript erforderlich)
- Spilling, C. D.: Thiophosphoryl Chloride, in Encyclopedia of Reagents for Organic Synthesis John Wiley & Sons, Weinheim, 2001. doi:10.1002/047084289X.rt104. Article Online Posting Date: April 15, 2001.
- Betterman, G.; Krause, W.; Riess, G.; Hofmann, T. “Phosphorus Compounds, Inorganic” Ullman’s Encyclopedia of Industrial Chemistry. John Wiley & Sons: New York, 2005. doi:10.1002/14356007.a19_527.
- Martin, D. R.; Duvall, W. M. “Phosphorus (V) Sulfochloride” Inorganic Syntheses, Volume IV. McGraw-Hill, 1953. doi:10.1002/9780470132357.ch24.
- Donald Ray Martin and Wilmer M. Duvall: Phosphorus(V) sulfochloride (Thiophosphoryl chloride). In: J. C. Bailar, Jr. (Hrsg.): Inorganic Syntheses. Band 4. McGraw-Hill, Inc., 1953, S. 71–74 (englisch).
- Fee, D. C.; Gard, D. R.; Yang, C. “Phosphorus Compounds” Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons: New York, 2005. doi:10.1002/0471238961.16081519060505.a01.pub2.

