Terpinylacetat
Terpinylacetat ist eine chemische Verbindung aus der Gruppe der Ester des Terpineols.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-%CE%B1-Terpinyl_acetate.svg.png.webp) | |||||||||||||
| (±)-α-Terpinylacetat | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Terpinylacetat | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C12H20O2 | ||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit charakteristischem Geruch[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 196,29 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||
| Dichte |
0,953 g·cm−3 (25 °C)[2] | ||||||||||||
| Siedepunkt |
220 °C[2] | ||||||||||||
| Löslichkeit | |||||||||||||
| Brechungsindex |
1,465 (20 °C)[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
Vorkommen
Terpinylacetat kommt vorwiegend in der α-, aber auch in der δ-Form natürlich in essentiellen Ölen von Zypressen,[4] Grüner Kardamom (Elettaria cardamomum),[5][6][7] Basilikum (Ocimum basilicum),[7] Sibirische Zirbelkiefern,[4] Pfeffer (Piper nigrum),[7] Perilla (Perilla frutescens),[7] Salbei (Salvia officinalis),[7] Thymian (Thymus longicaulis),[6] Eukalyptus (Eucalyptus globulus,[7] Eucalyptus citriodora,[7] Eucalyptus diversicolor ,[6] Eucalyptus moluccana [6]), Lorbeer (Laurus nobilis,[6][7] Umbellularia californica [6]), Pinien und weiteren vor.[8]
 Pinie
Pinie Kardamom
Kardamom Zypresse
Zypresse Basilikum
Basilikum Salbei
Salbei Lorbeer
Lorbeer
Isomerie
Das hauptsächlich in der Natur vorkommende α-Terpinylacetat ist eine chirale Verbindung mit einem Stereozentrum. Folglich existieren die zwei enantiomeren Formen (R)-α-Terpinylacetat und (S)-α-Terpinylacetat.
| Stereoisomere von α-Terpinylacetat | ||
| Name | (R)-α-Terpinylacetat | (S)-α-Terpinylacetat |
| Andere Namen | (+)-α-Terpinylacetat | (−)-α-Terpinylacetat |
| Strukturformel | -(%252B)-%CE%B1-Terpinyl_acetate.svg.png.webp) | -(%E2%80%93)-%CE%B1-Terpinyl_acetate.svg.png.webp) |
| CAS-Nummer | 7785-54-8 | 58206-95-4 |
| 80-26-2 (unspez.) | ||
| PubChem | 11469649 | 93317 |
| 111037 (unspez.) | ||
| Wikidata | Q27289621 | Q27259234 |
| Q4456134 (unspez.) | ||
Das β-Terpinylacetat ist ebenfalls ein Isomer, welches in der cis- und trans-Form vorliegt:
| β-Terpinylacetat und Isomere | |||
| Name | β-Terpinylacetat | cis-β-Terpinylacetat | trans-β-Terpinylacetat |
| Strukturformel | 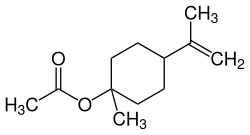 | 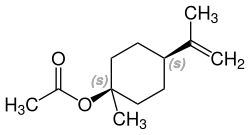 | 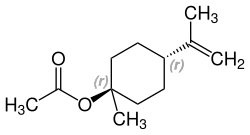 |
| CAS-Nummer | 10198-23-9 | 20777-47-3 | 59632-85-8 |
| PubChem | 88693 | – | – |
| Wikidata | Q27114875 | Q27262888 | Q27281706 |
Weitere Isomere sind das γ- und das δ-Terpinylacetat:
| γ- und δ-Terpinylacetat | ||
| Name | γ-Terpinylacetat | δ-Terpinylacetat |
| Strukturformel | 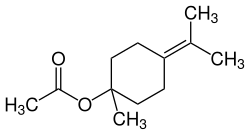 | 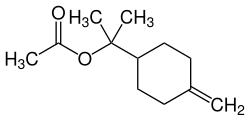 |
| CAS-Nummer | 10235-63-9 | 93836-50-1 |
| PubChem | 82480 | – |
| Wikidata | Q27114893 | – |
Gewinnung und Darstellung
Terpinylacetat kann durch Acetylierung von Terpineol oder gemischten isomeren Terpineolen unter Verwendung von Essigsäureanhydrid und wasserfreiem Natriumacetat gewonnen werden. Es kann auch aus 1,8-Cineol hergestellt werden. Die Verbindung wurde erstmals 1888 synthetisiert.[1][9]
Eigenschaften
Terpinylacetat ist eine farblose Flüssigkeit mit charakteristischem Geruch, die löslich in essentiellen Ölen und den meisten organischen Lösungsmitteln ist.[1]
Verwendung
Terpinylacetat wird als Geruchsstoff (Lavendel und Bergamotte-Typ[10][4]) und als Zwischenprodukt zur Herstellung von Carvon verwendet.[1]
Einzelnachweise
- George A. Burdock: Encyclopedia of Food and Color Additives. CRC Press, 1997, ISBN 978-0-8493-9414-0, S. 2995 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt α-Terpinyl acetate, FG bei Sigma-Aldrich, abgerufen am 8. November 2018 (PDF).
- David R. Lide: CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data. CRC Press, 1995, ISBN 978-0-8493-0595-5, S. 510 (eingeschränkte Vorschau in der Google-Buchsuche).
- Karl‐Georg Fahlbusch, Franz‐Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg: Flavors and Fragrances. In: Ullmann's Encyclopedia of Industrial Chemistry. Band 15, 2012, S. 73–198, doi:10.1002/14356007.a11_141.
- Klaus Roth: Chemische Leckerbissen. John Wiley & Sons, 2014, ISBN 978-3-527-33739-2, S. 199 (eingeschränkte Vorschau in der Google-Buchsuche).
- ALPHA-TERPINYL-ACETATE (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 11. Juli 2021.
- ALPHA-TERPINEOL ACETATE (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 11. Juli 2021.
- Norbert A. Braun, Manfred Meier u. a.: δ-Terpinyl Acetate. A New Natural Component from the Essential Leaf Oil of L. (Lauraceae). In: Journal of Essential Oil Research. 13, 2001, S. 95, doi:10.1080/10412905.2001.9699624.
- Ean-Tun Liaw, Kuan-Ju Liu: Synthesis of terpinyl acetate by lipase-catalyzed esterification in supercritical carbon dioxide. In: Bioresource Technology. 101, 2010, S. 3320, doi:10.1016/j.biortech.2009.11.081.
- Kurt Bauer, Dorothea Garbe, Horst Surburg: Common Fragrance and Flavor Materials Preparation, Properties and Uses. John Wiley & Sons, 2008, ISBN 3-527-61237-8, S. 69 (eingeschränkte Vorschau in der Google-Buchsuche).
