Takeda-Olefinierung
Die Takeda-Olefinierung ist eine Titan-vermittelte chemische Reaktion zur Olefinierung von Dithioacetalen (sowie -ketalen) und Carbonylverbindungen (Aldehyde, Ketone oder Ester), die von Takeshi Takeda 1997 publiziert wurde.[1][2] Sie gilt als vergleichsweise milde, nicht-basische Olefinierung für empfindliche Edukte zur Darstellung von di-, tri- und sogar tetrasubstituierten Olefinen.
Kupplungsreaktion
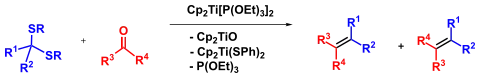
Da sich die Thioacetale aus Carbonylverbindungen darstellen lassen, kann man die Takeda-Olefinierung auch als Kupplungsreaktion zwischen zwei Carbonylverbindungen ansehen, ähnlich der McMurry-Kupplung. Statt Dithioacetalen können auch geminale Dihalogenide mittels zur Olefinierung von Carbonylgruppen verwendet werden,[3] was stark an die Takai- und Takai-Lombardo-Reaktionen erinnert.
Mechanismus
Die Takeda-Olefinierung läuft vermutlich über Ti-Carben-Spezies ab.[1] Diese Ti-Carbene reagieren mit Carbonylgruppen über viergliedrige Oxametallacyclobutane. Dieser Mechanismus erinnert an das intermediäre Oxaphosphetan der Wittig-Reaktionen, ist durch das Metallcarben-Intermediat aber stärker mit der Olefin-Metathese verwandt. Wird in der Anwesenheit von Olefinen dargestellt, kann dies wie bei den verwandten Rh-Carbenen zur Cyclopropanierung der Doppelbindung führen.[4]

Als alternativer Mechanismus wurde eine Dititanspezies analog der Takai-Reaktion vorgeschlagen.[1]
Darstellung der Edukte
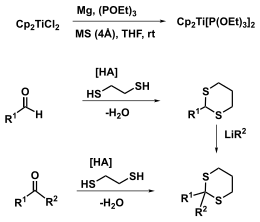
Der Titanocenbis(triethylphosphit) lässt sich durch Reduktion von Titanocendichlorid Cp2Ti(IV)Cl2 mit Magnesium in Gegenwart von Triethylphosphit und Molsieb darstellen.
Dithioacetale und -ketale lassen sich leicht aus Aldehyden und Ketonen durch Reaktion mit Thiolen oder Dithiolen herstellen. Thioketale können alternativ aus den Thioacetalen hervorgehen (Corey-Seebach). Thioketale werden oft als Schutzgruppen verwendet, wodurch sich viele Anknüpfungspunkte der Takeda-Olefinierung in der Totalsynthese ergeben.
Vergleich mit anderen Methoden
Generell laufen Titan-vermittelte Olefinierungen (Tebbe, Petasis, Takai, Lombardo, McMurry) mit einer Bandbreite an Carbonylverbindungen (Aldehyde, Ketone, Ester, Laktone, Amide) ab, wohingegen andere Olefinierungen (Wittig, Julia, Peterson) meist auf Aldehyde und Ketone begrenzt sind. Zusätzlich sind Titan-vermittelte Olefinierungen vergleichsweise mild und tolerieren eine Reihe von funktionellen Gruppen sowie leicht enolisierbare alpha-chirale Carbonylverbindungen, da diese Reaktionen unter nicht-basischen Bedingungen ablaufen. Auf der anderen Seite beschränkt sich der praktische Einsatz der Ti-basierten Olefinierungen oft auf Methenylierungen (Tebbe, Petasis, Takai-Methylenierung, Takai-Lombardo-Methylenierung). Die Erweiterungen dieser Methoden (Takai-Utimoto und Takai-Lombardo-Olefinierung) benötigen als Reaktionspartner geminale Dihalogenide oder deren Analoga, deren Darstellung bislang eher mühsam war.
In der Totalsynthese von Naturstoffen sind u. a. intramolekulare Versionen der Takeda-Reaktion beliebt, da sich somit die Regioselektivität (E/Z-Selektivität) der Takeda-Olefinierung geometrisch erzwingen lässt.
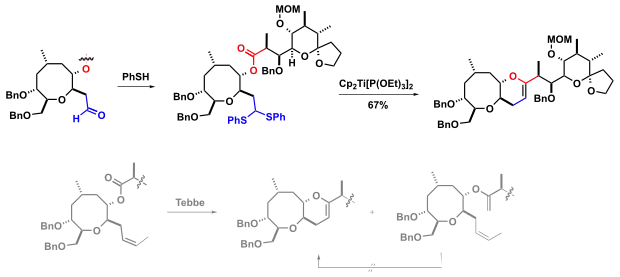
Bei der Synthese von Ciguatoxin CTX3C nutzen Hirama und Mitarbeiter die Takeda Olefinierung.[5] Der ursprüngliche Syntheseplan der Autoren sah stattdessen eine Tebbe-Methylenierung mit anschließender Olefinmetathese (RCM) vor. Die Tebbe-Reaktion lieferte jedoch eine Produktmischung und die geplante Ringschlussmetathese des Bis-Olefins war nicht erfolgreich.
Einzelnachweise
- Yasuo Horikawa, Mikako Watanabe, Tooru Fujiwara, Takeshi Takeda: New Carbonyl Olefination Using Thioacetals. In: Journal of the American Chemical Society. Band 119, Nr. 5, Februar 1997, ISSN 0002-7863, S. 1127–1128, doi:10.1021/ja962240d.
- Takeshi Takeda: Organic Syntheses Utilizing Titanium Carbene Complexes. In: Bulletin of the Chemical Society of Japan. Band 78, Nr. 2, Februar 2005, ISSN 0009-2673, S. 195–217, doi:10.1246/bcsj.78.195.
- Takeshi Takeda, Rika Sasaki, Tooru Fujiwara: Carbonyl Olefination by Means of a gem -Dichloride−Cp 2 Ti[P(OEt) 3 ] 2 System. In: The Journal of Organic Chemistry. Band 63, Nr. 21, Oktober 1998, ISSN 0022-3263, S. 7286–7288, doi:10.1021/jo980724h.
- Bernhard Breit: Dithioacetals as an Entry to Titanium–Alkylidene Chemistry: A New and Efficient Carbonyl Olefination. In: Angewandte Chemie International Edition. Band 37, Nr. 4, 1998, ISSN 1521-3773, S. 453–456, doi:10.1002/(SICI)1521-3773(19980302)37:43.0.CO;2-M.
- Hisatoshi Uehara, Tohru Oishi, Masayuki Inoue, Mitsuru Shoji, Yoko Nagumo, Masashi Kosaka, Jean-Yves Le Brazidec, Masahiro Hirama: Convergent synthesis of the HIJKLM ring fragment of ciguatoxin CTX3C. In: Tetrahedron. Band 58, Nr. 32, August 2002, S. 6493–6512, doi:10.1016/S0040-4020(02)00660-9.