McMurry-Reaktion
Die McMurry-Reaktion ist in der Chemie eine Namensreaktion und nach dem Chemiker John E. McMurry benannt, der sie 1974 publizierte. Der japanische Chemiker Teruaki Mukaiyama (1927–2018) entdeckte bereits 1973 die Bildung von Alkenen (und Pinakolen) aus Aldehyden und Ketonen durch Behandlung mit niedervalenten Titanreagentien (TiCl4/LiAlH4).[1] Tyrlik et al. beschrieben – ebenfalls 1973 – die Verwendung von TiCl3/Mg für diese Alken-Synthese.[2] –
Bei der McMurry-Reaktion werden zwei Ketone oder Aldehyde zu einem Alken in Gegenwart eines Titanchlorids, wie z. B. Titan(III)-chlorid, und eines Reduktionsmittels dimerisiert (gekoppelt).[3] Die McMurry-Reaktion dient hauptsächlich zur Herstellung symmetrischer Alkene und stellt besonders für die Synthese sterisch anspruchsvoll substituierter Alkene ein wichtiges Verfahren dar und kann als Umkehrung der Ozonolyse betrachtet werden.
Reaktion
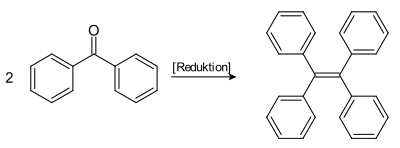
Aliphatische sowie aromatische Aldehyde oder Ketone (auch cyclische Ketone) lassen sich in hohen Ausbeuten zu symmetrischen Alkenen reduktiv dimerisieren.[3][4] Hierbei dient niedervalentes Titan (TiCl2/LiAlH4)als Reduktionsmittel, das durch Reduktion von Titan(III)-chlorid (TiCl3) oder Titan(IV)-chlorid (TiCl4) mit z. B. Lithiumaluminiumhydrid (LiAlH4) bzw. Zink oder Magnesium erhalten wird.
Reaktionsmechanismus
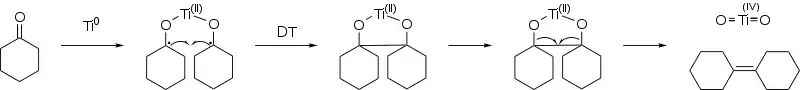
Der Reaktionsmechanismus der McMurry-Reaktion verläuft je nach verwendetem Reduktionsmittel unterschiedlich und nicht zwingend über metallisches Titan(0) als niedervalente Titanverbindung, wie lange Zeit vermutet wurde.[5][6] So konnte z. B. gezeigt werden, dass bei Verwendung von Lithiumaluminiumhydrid (LiAlH4) als Reduktionsmittel ein Hydridtitanchlorid [HTiCl(THF)0.5]x als reaktive Titanspezies gebildet wird.[7][6]
Bei der heute wegen ihrer hohen Ausbeuten häufig verwendeten Variante mit Zink als Reduktionsmittel konnte hingegen gezeigt werden, dass die Reduktion von Titan(III)-chlorid (TiCl3) [oder Titan(IV)-chlorid (TiCl4)] erst nach Bildung eines Titan(III)-Carbonylkomplexes stattfindet und zur Bildung eines Titan(II)-Carbonylkomplexes führt.[7] In einem ersten Schritt erfolgt dann eine Pinakolatbildung, im zweiten Schritt die Desoxygenierung des Pinakolates zum Alken. Bei aromatischen Aldehyden und Ketonen verläuft die Pinakolatbildung über eine carbenoide Zwischenstufe, während bei aliphatischen Aldehyden und Ketonen die Pinakolatbildung über eine radikalische Zwischenstufe verläuft.
Unsymmetrisch substituierte Alkene aus Gemischen zweier unterschiedlicher Ketone sind mit der Mc-Murry-Reaktion nur in unbefriedigenden Ausbeuten zugänglich, wenn eine der Komponenten im Überschuss vorliegt.
Wenn die Reaktanten nicht erwärmt und die Reaktionszeit kurz gehalten wird, ist es möglich, dass nur der erste Reaktionsschritt erfolgt. Es werden nur 1,2-Diole als Reaktionsprodukte erhalten. In diesem Fall handelt es sich um eine einfache Pinakol-Kupplung unter McMurry-Bedingungen. Ein Beispiel für die Reaktion unter diesen Bedingungen ist die Taxol-Synthese nach Nicolaou.
Beispiele
Die Originalpublikation beschreibt die Kupplung von Retinal zum Carotin mit Titan(III)-chlorid / Lithiumaluminiumhydrid. Ähnlich wird Tetraphenylethen aus Benzophenon synthetisiert. Andere Dimerisierungen, die in der Originalpublikation beschrieben werden, sind die von Adamantanon und Dihydrozibeton. Eine Anwendung der McMurry-Reaktion mit Titan(IV)-chlorid und Zink beschäftigt sich mit der Synthese eines Nanomotors.[8]
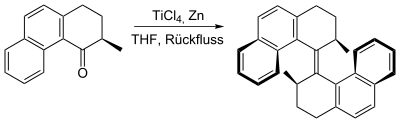
Vergleich und Alternativen
Gekreuzte McMurry-Kupplungen zwischen zwei unterschiedlichen Carbonylverbindungen sind in der Regel durch die Möglichkeit zur Homodimerisierung eingeschränkt - eine Komplikation wie man sie auch von einfachen Aldol-Reaktionen kennt. Die intramolekularen Versionen der McMurry-Kupplung können allerdings sehr effektiv sein zur Darstellung von Makrocyclen oder sterisch gespannten Olefinen, vor allem bei hoher Verdünnung. Als Alternativen für die Kupplung zweier unterschiedlicher Carbonylverbindungen bieten sich die Takeda-Olefinierung oder die Barton-Olefinierung an, bei denen die Carbonylgruppe einer der beiden Reaktionspartner zuvor in ein Schwefel-Derivat überführt wird.
Einzelnachweise
- Dieter Seebach: Teruaki Mukaiyama (1927–2018). In: Angewandte Chemie, Band 131, 2019, S. 5859–5860. doi:10.1002/ange.201902440.
- Claudia Betschart, Dieter Seebach: Anwendungen niedervalenter Titan-Reagentien in der Organischen Synthese, Chimia 43 (1989), S. 39–49.
- John E. McMurry und Michael P. Fleming: New method for the reductive coupling of carbonyls to olefins. Synthesis of β-carotene. Journal of the American Chemical Society. Band 96, 1974, S. 4708–4709, doi:10.1021/ja00821a076.
- Jerry March: Advanced Organic Chemistry. 4. Auflage, Wiley-Interscience, ISBN 0-471-60180-2.
- Michel Ephritikhine: A new look at the McMurry reaction. In: Chem. Commun. 1998, S. 2549–2554, doi:10.1039/a804394i.
- Alois Fürstner und Borislav Bogdanovic: Neue Entwicklungen in der Chemie von niedervalentem Titan. In: Angewandte Chemie, Band 108, 1996, S. 2583–2609. doi:10.1002/ange.19961082104.
- Borislav Bogdanovic und Andreas Bolte: A comparative study of the McMurry reaction utilizing [HTiCl(THF)0.5)]x, TiCl3(DME)1.5-Zn(Cu) and TiCl2*LiCl as coupling reagents. In: J. Organomet. Chem. Band 502, 1995, S. 109–121, doi:10.1016/0022-328X(95)05755-E.
- Matthijs K. J. ter Wiel, Richard A. van Delden, Auke Meetsma, and Ben L. Feringa: Light-Driven Molecular Motors: Stepwise Thermal Helix Inversion during Unidirectional Rotation of Sterically Overcrowded Biphenanthrylidenes. In: J. Am. Chem. Soc.. 127, Nr. 41, 2005, S. 14208. doi:10.1021/ja052201e.