Julia-Olefinierung
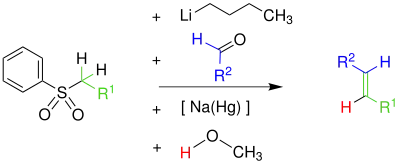
Bei der Julia-Olefinierung (auch Julia-Lythgoe-Olefinierung genannt) handelt es sich um eine Namensreaktion in der Organischen Chemie, die nach ihrem Entdecker dem französischen Chemiker Marc Julia benannt wurde.[1] Sie ist eine chemische Reaktion von Phenylsulfonen mit Aldehyden oder Ketonen und dient der Herstellung von Alkenen. Die Julia-Olefinierung ist neben anderen Methoden ein Standard-Verfahren zur Herstellung von Kohlenstoff-Kohlenstoff-Doppelbindungen (Carbonyl-Olefinierung).
Mechanismus
Im ersten Schritt wird das Phenylsulfon durch Butyllithium deprotoniert. Das Phenylsulfon-Anion reagiert nucleophil mit der Carbonylgruppe eines Aldehyds zu einem Alkoholat, welches in einem weiteren Schritt verestert wird. Der Ester wird mit Hilfe von Natriumamalgam [Na(Hg)] oder Samarium(II)-iodid zum Alken eliminiert.[2] Der exakte Mechanismus der Eliminierung ist unbekannt – jedoch ist davon auszugehen, dass der Mechanismus ein Radikalmechanismus unter Beteiligung eines Vinylradikals ist. Die folgende Abbildung zeigt, wie der Mechanismus nach der Literatur[3] verläuft. Alle Schritte können als Eintopf-Reaktion durchgeführt werden. Es entstehen bei dieser Reaktion bevorzugt (E)-Alkene (trans-Alkene).[4][5]
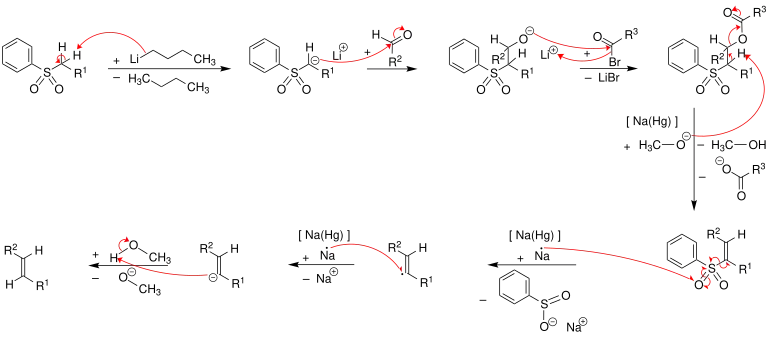
Die Konfiguration des erhalten Alkens hängt nicht von der Konfiguration des Sulfonintermediates ab und daher nimmt man an, dass sich auf der Stufe des Vinylradikals eine thermodynamisch stabile (E)-Konfiguration ausbilden kann.
Varianten
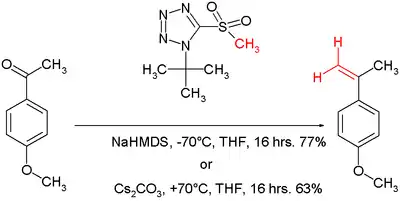
Von der Julia-Reaktion ist nach Philip Kocienski eine Variante als Julia-Kocienski-Olefinierung bekannt.[6] Das Nucleophil ist hier ein Tetrazol. Der Mechanismus ist der gleiche wie bei der Julia-Olefinierung. Die Reaktionsbedingungen können zwischen −70 °C mit Natrium-bis(trimethylsilyl)amid als Base und +70 °C mit Caesiumcarbonat als Base jeweils in THF variiert werden.[7]
Einzelnachweise
- Marc Julia, Jean-Marc Paris: Syntheses a l’aide de sulfones v(+)- methode de synthese generale de doubles liaisons. In: Tetrahedron Letters. Band 14, Nr. 49, 1973, S. 4833–4836, doi:10.1016/S0040-4039(01)87348-2.
- Gary E. Keck, Kenneth A. Savin, Michael A. Weglarz: Use of Samarium Diiodide as an Alternative to Sodium/Mercury Amalgam in the Julia-Lythgoe Olefination. In: The Journal of Organic Chemistry. Band 60, Nr. 10, 1. Mai 1995, S. 3194–3204, doi:10.1021/jo00115a041.
- L. Kürti, B. Czakó: Strategic Applications Of Named Reactions In Organic Synthesis. Elsevier Academic Press, USA 2005, S. 230.
- Philip Kocienski: Recent Sulphone-Based Olefination Reactions. In: Phosphorus and Sulfur and the Related Elements. Band 24, Nr. 1–2, 1. Juni 1985, S. 97–127, doi:10.1080/03086648508073398.
- Sarah E. Kelly: 3.1 - Alkene Synthesis. In: Ian Fleming, Barry M. Trost (Hrsg.): Comprehensive Organic Synthesis. Pergamon, Oxford 1991, ISBN 978-0-08-052349-1, S. 729–817, hier S. 792–806.
- Paul R. Blakemore, William J. Cole, Philip J. Kocieński, Andrew Morley: A Stereoselective Synthesis of trans -1,2-Disubstituted Alkenes Based on the Condensation of Aldehydes with Metallated 1-Phenyl-1 H -tetrazol-5-yl Sulfones. In: Synlett. Band 1998, Nr. 01, Januar 1998, S. 26–28, doi:10.1055/s-1998-1570.
- Christophe Aïssa: Improved Julia−Kocienski Conditions for the Methylenation of Aldehydes and Ketones. In: The Journal of Organic Chemistry. Band 71, Nr. 1, 1. Januar 2006, S. 360–363, doi:10.1021/jo051693a.