Synaptisches Vesikel
Als synaptisches Vesikel oder synaptisches Bläschen wird ein Vesikel (Bläschen) in der präsynaptischen Endigung einer Nervenzelle bezeichnet, das membranumhüllt Neurotransmitter enthält.
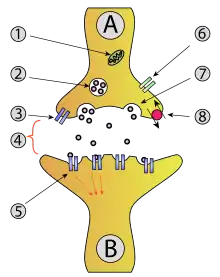
(synaptische Transmission)
1 – Mitochondrium
2 – synaptisches Vesikel
3 – präsynaptischer Autorezeptor
4 – synaptischer Spalt mit Transmitter
5 – postsynaptischer Rezeptor
6 – Calciumkanal
7 – Freisetzung durch Exozytose
8 – Aktiver Transport, eventuell mit Wiederaufnahme von Neurotransmitter
Synaptische Vesikel sind notwendige Elemente für die Erregungsübertragung an einer chemischen Synapse zwischen Nervenzellen und anderen nachgeschalteten Zellen. Die im Zytoplasma der präsynaptischen Region an der Zellmembran gelegenen synaptischen Vesikel können auf ein Aktionspotential hin mit dieser verschmelzen und so per Exozytose ihr jeweiliges Quantum an Neurotransmitter in den synaptischen Spalt freisetzen.
Eigenschaften
Synaptische Vesikel sind kleine einheitlich gebaute Organellen eines Neurons, deren kugelförmiger membranumhüllter Flüssigkeitsraum eine bestimmte Menge an spezifischen Botenstoffmolekülen enthält. Klassische niedermolekulare Neurotransmitter sind der Inhalt von kleinen synaptischen Vesikeln (englisch small synaptic vesicles, SSV).[1] Deren mittlerer Durchmesser kann von Synapse zu Synapse variieren[2] und liegt bei 30 bis 50 nm.[3]
Daneben sind manchmal noch größere Vesikel mit dichterem Kernbereich (englisch large dense-core vesicles, LDCV) und einem Durchmesser von 100–300 nm anzutreffen, die zumeist als Neuromodulatoren wirkende Neuropeptide enthalten.[1] Nicht selten finden sich so in einer Präsynapse unterschiedliche Vesikeltypen mit verschiedenen Neurotransmittern beziehungsweise Kotransmittern.
Wenn ein synaptisches Vesikel in unmittelbarer Nähe zur Zellmembran der präsynaptischen Region einer Axonterminale liegt, so kann es nach Eintreffen eines Aktionspotentials am synaptischen Endknopf vermittelt durch intrazelluläre Calcium-abhängige Signale zu einer Verschmelzung der Vesikelmembran mit der Zellmembran kommen. Diese Membranfusion ist Voraussetzung für den Exozytose genannten Vorgang, bei dem der Vesikelinhalt in den extrazellulären Raum entleert wird. Auf diese Weise wird hier das enthaltene Quantum an Neurotransmitter von einem Neuron in den schmalen synaptischen Spalt freigesetzt, und erreicht per Diffusion die postsynaptische Region der nachgeordneten Zelle, in deren Zellmembran spezifische Rezeptorproteine für den jeweiligen Transmitter eingebaut sind.
Die Vesikelfüllung peptiderger Neuronen ist das Produkt einer Biosynthese im Golgi-Apparat. Einfacher gebaute Transmitter wie beispielsweise Acetylcholin können im Zytoplasma der Axonterminale synthetisiert und mittels Membrantransportern in synaptischen Vesikeln angereichert werden. Daneben ist bei verschiedenen Neuronen eine teilweise Wiederaufnahme von ausgeschüttetem Transmitter bzw. dessen Abbauprodukten möglich. Durch Abschnürung der Zellmembran nach innen als Endozytose im zuvor fusionierten Bereich besteht die Möglichkeit, Vesikelmembran zu recyceln (Synaptisches Vesikel-Recyling).[4]
Bei vielen Neuronen scheint unter physiologischen Bedingungen nur ein Teil der synaptischen Vesikel mobilisiert zu werden, der übrige Anteil wird als Reservepool bezeichnet. Unter nicht physiologischen Bedingungen – in Zellkulturen bestimmter Neuronen (Pyramidalzellen aus der Hippocampusregion CA 1 von Ratten), die einzeln isoliert Synapsen auf sich selbst (Autapsen) bildeten – konnte bei zehnminütiger Reizung mit Frequenzen von 0,2 Hertz auch ein erheblicher Teil dieser Reservevesikel zur Entleerung gebracht werden.[5]
Ein Parameter für das Quantum an freisetzbarem Transmitter ist die jeweilige Vesikelgröße. Im menschlichen Gehirn besitzen synaptische Vesikel von Neuronen im primären visuellen Cortex (V1) einen mittleren Durchmesser von etwa 40 nm.[2]
Synaptische Vesikel bestehen zu über 60 Prozent ihrer Masse aus Proteinen.[3] Ihre Membran ist dabei mit etwa 600 Transmembrandomänen durchsetzt, die etwa ein Viertel der Membranfläche einnehmen.[3] Die Membran gereinigter synaptischer Vesikel enthält Proteine und Phospholipide, wobei sich die Phospholipide zusammensetzen aus ungefähr 40 % Phosphatidylcholin, 32 % Phosphatidylethanolamin, 12 % Phosphatidylserin, 5 % Phosphatidylinositol und 10 % Cholesterol.[6]
An Proteinen enthält die Vesikelmembran mehr als 400 verschiedene Proteintypen, etwa 40 davon als integrale Membranproteine. Während die einen H+-Gradienten aufbauende V-ATPase nur in ein oder zwei Kopien vorhanden ist, liegen verschiedene Ionenkanal-Proteine je zahlreich vor, ebenso weitere Transportproteine für die Aufnahme der Neurotransmittermoleküle in die Vesikel (durch Antiport). Besondere Proteine ermöglichen die Prozesse der Exozytose bzw. Endozytose, so etwa 20 verschiedene SNARE-Membranproteine.[7] Für die Fusion der Membran eines synaptischen Bläschens mit der Zellmembran sind sowohl spezifische Proteine in der Vesikelmembran (wie Synaptobrevin, Synaptophysin und Synaptotagmin) als auch in der aktiven Zone der präsynaptischen Zellmembran (wie Syntaxine und Neurexine) erforderlich. Bei den intrazellulären Verlagerungen von Vesikeln spielen verschiedene Rab-Proteine ihrer Membran eine Rolle.
Membrantransport von Neurotransmittern in synaptische Vesikel (durch Antiporter)
| Neurotransmitter | Einwärts gerichtet | Auswärts gerichtet |
|---|---|---|
| Noradrenalin, Dopamin, Histamin, Serotonin and Acetylcholin | Neurotransmitter+ | 2 H+ |
| GABA, Glycin | Neurotransmitter | 1 H+ |
| Glutamat | Neurotransmitter− + Cl− | 1 H+ |
Verschiedene Toxine hemmen die Vesikelfusion mit der präsynaptischen Zellmembran, z. B. Batrachotoxin, Tetanustoxin, Botulinumtoxin[8] und alpha-Latrotoxin.
Geschichte
Im Jahr 1950 wurde erstmals beobachtet, dass in Froschnervenzellen die Freisetzung von Neurotransmittern nach Eintreffen des präsynaptischen Aktionspotenzials in größeren, diskreten Einheiten erfolgte.[9][10] Unter einem Transmissionselektronenmikroskop waren von George Palade und Kollegen zudem kleine Vesikel in den präsynaptischen Endigungen beobachtet worden.[11][12] Darauf basierend wurde die „Vesikel-Hypothese“ entwickelt.[13][14] Die Bezeichnung synaptisches Vesikel wurde im Jahr 1954 erstmals verwendet.[15] Im Jahr 1962 wurden durch Zellfraktionierung als Synaptosomen bezeichnete synaptische Vesikel isoliert.[16] Durch hypoosmotischen Zellaufschluss wurde die Reinigung der Synaptosomen verbessert und gezeigt, dass die Vesikel Acetylcholin enthielten.[17][18][19] Es wurden etwa 1000 Acetylcholin-Moleküle pro Vesikel ermittelt.[20] Die Freisetzung des Vesikelinhalts wurde in unterschiedlichen Tierarten repliziert.[21][22] Die höchsten Konzentrationen an synaptischen Vesikeln wurden im elektrischen Organ von Zitterrochen gefunden.[23][24]
Einzelnachweise
- Y. Park, K. Kim: Short-term plasticity of small synaptic vesicle (SSV) and large dense-core vesicle (LDCV) exocytosis. In: Cellular Signalling. Band 21, Nr. 10, Oktober 2009, ISSN 1873-3913, S. 1465–1470, doi:10.1016/j.cellsig.2009.02.015, PMID 19249357.
- Lei Qu, Yulia Akbergenova, Yunming Hu, Thomas Schikorski: Synapse-to-synapse variation in mean synaptic vesicle size and its relationship with synaptic morphology and function. In: The Journal of Comparative Neurology. Band 514, Nr. 4. Wiley Inter Science, März 2009, ISSN 1096-9861, S. 343–352, doi:10.1002/cne.22007, PMID 19330815.
- K. R. Poudel, J. Bai: Synaptic vesicle morphology: a case of protein sorting? In: Current opinion in cell biology. Band 26, Februar 2014, ISSN 0955-0674, S. 28–33, doi:10.1016/j.ceb.2013.09.001, PMID 24529243, PMC 4079907 (freier Volltext).
- S. Rizzoli, John M. Bekkers: Synaptic vesicle recycling: steps and principles. In: The EMBO Journal. Band 33, Nr. 8, 13. April 2014, ISSN 0261-4189, S. 788–822, doi:10.1002/embj.201386357, PMID 24596248, PMC 4194108 (freier Volltext).
- Kaori Ikeda, John M. Bekkers: Counting the number of releasable synaptic vesicles in a presynaptic terminal. In: Proceedings of the National Academy of Sciences. Band 106, Nr. 8, 2009, ISSN 0027-8424, S. 2945–2950, doi:10.1073/pnas.0811017106, PMID 19202060, PMC 2650301 (freier Volltext).
- F. Benfenati, P. Greengard, J. Brunner, M. Bähler: Electrostatic and hydrophobic interactions of synapsin I and synapsin I fragments with phospholipid bilayers. In: The Journal of Cell Biology. Band 108, Nr. 5, Mai 1989, ISSN 0021-9525, S. 1851–1862, PMID 2497105, PMC 2115549 (freier Volltext).
- S. Takamori, M. Holt, K. Stenius, E. Lemke, M. Grønborg, D. Riedel, H. Urlaub, S. Schenck, B. Brügger, P. Ringler, S. Müller, B. Rammner, F. Gräter, J. Hub, B. De Groot, G. Mieskes. Y. Moriyama, J. Klingauf, H. Grubmüller, J. Heuser, F. Wieland, R. Jahn: Molecular Anatomy of a Trafficking Organelle. In: Cell, Band 127, Nummer 4, November 2006, S. 831–846; doi:10.1016/j.cell.2006.10.030.cell.com (PDF; 1 MB).
- Hans-Christian Pape, Armin Kurtz, Stefan Silbernagl (Hrsg.): Physiologie. 7. Auflage. Thieme, Stuttgart 2014, ISBN 978-3-13-796007-2, S. 146.
- Paul Fatt, Bernard Katz: Some observations on biological noise. In: Nature. Band 166, Nr. 4223, 7. Oktober 1950, S. 597–598, doi:10.1038/166597a0, PMID 14780165, bibcode:1950Natur.166..597F.
- Paul Fatt, Bernard Katz: Spontaneous subthreshold activity at motor nerve endings. In: The Journal of Physiology. Band 117, Nr. 1, 28. Mai 1952, ISSN 0022-3751, S. 109–128, PMID 14946732, PMC 1392564 (freier Volltext).
- Sanford L. Palay, George E. Palade: American association of anatomists. Sixty-seventh annual session. In: The Anatomical Record. Band 118, Nr. 2, 1954, Electron microscope study of the cytoplasm of neurons., S. 275–454, hier S. 336, doi:10.1002/ar.1091180211 (Textarchiv – Internet Archive).
- Eduardo D. P. De Robertis, H. Stanley Bennett: Some Features of the Submicroscopic Morphology of Synapses in Frog and Earthworm. In: The Journal of Biophysical and Biochemical Cytology. Band 1, Nr. 1, 25. Januar 1955, ISSN 0095-9901, S. 47–58, PMID 14381427, PMC 2223594 (freier Volltext), JSTOR:1602913.
- José del Castillo, Bernard Katz: Quantal components of the end-plate potential. In: The Journal of Physiology. Band 124, Nr. 3, 28. Juni 1954, ISSN 0022-3751, S. 560–573, PMID 13175199, PMC 1366292 (freier Volltext).
- José del Castillo, Bernard Katz: Biophysical aspects of neuro-muscular transmission. In: Progress in Biophysics and Biophysical Chemistry. Band 6, 1956, ISSN 0096-4174, S. 121–170, PMID 13420190.
- Eduardo D. P. De Robertis, H. Stanley Bennett: Submicroscopic vesicular component in the synapse. (1954). In: Fed Proc. Band 13, S. 35.
- E. G. Gray, V. P. Whittaker: The isolation of nerve endings from brain. In: Journal of Anatomy. Band 96, Teil 1, 1962, ISSN 0021-8782, S. 79–88.8, PMID 13901297, PMC 1244174 (freier Volltext).
- V. P. Whittaker, I. A. Michaelson, R. J. Kirkland: The separation of synaptic vesicles from disrupted nerve-ending particles. In: Biochemical Pharmacology. Band 12, Nr. 3, März 1963, S. 300–302, doi:10.1016/0006-2952(63)90156-4.
- V. P. Whittaker, I. A. Michaelson, R. J. Kirkland: The separation of synaptic vesicles from nerve-ending particles (‘synaptosomes’). In: Biochemical Journal. Band 90, Nr. 2, Februar 1964, S. 293–303, PMID 5834239, PMC 1202615 (freier Volltext).
- E. De Robertis, G. Rodriguez de Lores Arnaiz, G. L. Salganicoff, A. Pellegrino de Iraldi, L. M. Zieher: Isolation of Synaptic Vesicles and Structural Organization of the Acetylcholine System Within Brain Nerve Endings. In: Journal of Neurochemistry. Band 10, Nr. 4, 1963, ISSN 0022-3042, S. 225–235, doi:10.1111/j.1471-4159.1963.tb05038.x.
- V. P. Whittaker, M. N. Sheridan: the Morphology and Acetylcholine Content of Isolated Cerebral Cortical Synaptic Vesicles. In: Journal of Neurochemistry. Band 12, Nr. 5, Mai 1965, ISSN 0022-3042, S. 363–372, doi:10.1111/j.1471-4159.1965.tb04237.x, PMID 14333293.
- W. S. Wilson, R. A. Schulz, J. R. Cooper: The Isolation of Cholinergic Synaptic Vesicles From Bovine Superior Cervical Ganglion and Estimation of Their Acetylcholine Content. In: Journal of Neurochemistry. Band 20, Nr. 3, 1973, ISSN 0022-3042, S. 659–667, doi:10.1111/j.1471-4159.1973.tb00026.x, PMID 4574192.
- D. G. Jones: The isolation of synaptic vesicles from octopus brain. In: Brain Research. Band 17, Nr. 2, 20. Januar 1970, ISSN 0006-8993, S. 181–193, doi:10.1016/0006-8993(70)90077-6, PMID 5412681.
- M. Israël, J. Gautron, B. Lesbats: Fractionnement de L’organe Electrique de la Torpille. Localisation Subcellulaire de L’acetylcholine Subcellular Fractionation of the Electric Organ of Torpedo Marmorata. In: Journal of Neurochemistry. Band 17, Nr. 10, Oktober 1970, ISSN 0022-3042, S. 1441–1450, doi:10.1111/j.1471-4159.1970.tb00511.x, PMID 5471906.
- V. P. Whittaker, W. B. Essman, G. H. Dowe: The isolation of pure cholinergic synaptic vesicles from the electric organs of elasmobranch fish of the family Torpedinidae. In: Biochemical Journal. Band 128, Nr. 4, Juli 1972, ISSN 0264-6021, S. 833–845, PMID 4638794, PMC 1173903 (freier Volltext).