Superantigen
Superantigene (SAG, SAg) sind Antigene, die, unabhängig von APC (antigen-präsentierenden-Zellen)[1] zu einer Überaktivierung von T-Lymphozyten führen und dadurch toxisch wirken.
Eigenschaften

Superantigene sind die potentesten Aktivatoren von T-Lymphozyten und stehen im Zusammenhang mit einer Vielzahl von Krankheiten, welche sich auf die T-Zelltoxizität zurückführen lassen. Bei normalen Antigenen führt die Ausbildung von Zell-Zell-Kontakten zwischen MHC-gebundenen Peptiden auf antigenpräsentierenden Zellen und T-Zell-Rezeptoren (TCR) auf T-Lymphozyten zur Einleitung einer adaptiven Immunantwort. Bei Superantigenen dagegen erfolgt diese T-Lymphozyten-Aktivierung antigenunspezifisch und unter Umgehung der Prozessierung durch antigenpräsentierende Zellen, indem das Superantigen als Brücke Rezeptoren verbindet: Während konventionelle Antigene mit lediglich 0,01 % bis 1 % aller T-Zellen reagieren, liegt dieser Anteil bei Superantigenen bei 5 % bis 20 % (s. u.). Die in der Folge polyklonal vermehrten T-Zellen stoßen nahezu unkontrolliert Zytokine aus, was eine gezielte Immunabwehr vereitelt.[2] Für das von Streptokokken produzierte Superantigen SMEZ-2 lässt sich eine Aktivität schon im Femtogramm-Bereich pro Milliliter nachweisen, womit dies bis dato (2005) das potenteste unter den bakteriellen Superantigenen ist.
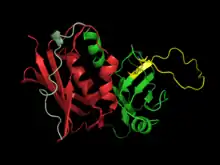
Struktur der Superantigene
SAG sind bifunktionelle Moleküle, die simultan die Rezeptorbindungsstellen von Klasse-II-MHC-Molekülen der Antigen-präsentierenden Zellen (APC) mit den T-Zellrezeptor Vβ-Elementen (TCR Vβ) und CD28 der T-Zellen verbinden können.[3][4] Dadurch können sie auf negative Weise die Interaktion zwischen Klasse-II-MHC-Molekülen und TCR modulieren, indem sie ein Trimer (MHC-II / SAG / TCR) bilden. Nicht zuletzt die Struktur der Superantigene ist die Ursache für deren hohe Stabilität gegenüber Proteasen und Hitze. Im Gegensatz zu konventionellen Antigenen, deren Epitope eine Größe zwischen etwa acht und siebzehn Aminosäuren aufweisen, sind bakterielle SAGs bezüglich ihrer Molaren Masse Proteine mit einer Größe von 20–30 kDa. Bei Streptokokken findet man in der Regel Superantigene in einer Größe von 24–28 kDa. Die meisten SAGs sind globuläre Proteine. Strukturanalysen ergaben, dass sie aus einer einzelnen Kette bestehen, geformt aus zwei globulären Domänen. Man geht davon aus, dass die Superantigene der Staphylokokken und Streptokokken gemeinsame Ursprünge haben, zumal man bei Aminosäuresequenzvergleichen Übereinstimmungen von 20 % bis 90 % finden kann.
Superantigene als konventionelle Antigene
Superantigene wirken auch in vermindertem Maß als Antigene im Rahmen einer adaptiven Immunantwort. So kann man in Patientenseren auch die Immunglobuline IgE und IgG gegen SAGs nachweisen. Am Beispiel der Staphylokokken-Enterotoxine A, B und TSST-1 konnte gezeigt werden, dass auf diesem Weg eine IgE-vermittelte Histaminfreisetzung stattfindet und somit Entzündungsreaktionen verstärkt werden. In anderen Experimenten trat der bisher noch ungeklärte Effekt auf, dass bei Patienten mit einer S. pyogenes-Infektion eine konstitutive Expression von SPEA (Streptococcal Pyrogenic Exotoxin A) stattfand. Durch die permanente Bildung von SPEA ist es dem befallenen Organismus auf Dauer theoretisch möglich, neutralisierende Antikörper gegen das Toxin zu bilden. Jedoch konnte im Fall von SPEA im Verlauf einer akuten Erkrankung keine Antikörperbildung nachgewiesen werden, was einen dramatischeren Verlauf zur Folge haben kann. Dass Superantigene auch als klassische Antigene wirken können, ist insofern interessant, als man mit kleinen Mengen oder Toxoiden eine Impfung vornehmen kann. Dieser Ansatz konnte am Tiermodell verifiziert werden. Die Prognose für einen Krankheitsverlauf könnte somit positiver ausfallen.
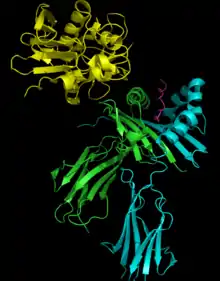
Bindungsarten an Zielzellen
Für die Interaktion mit den Zielzellen haben SAG mindestens zwei Klasse-II-MHC-Molekül-Bindungsstellen, die sich unter den SAG unterscheiden. Zur Bindung stehen ihnen dabei eine niedrig affine Bindungsstellen an der α-Kette und/oder hoch affine, zinkabhängige Bindungsstellen an der β-Kette von Klasse-II-MHC-Molekülen zur Verfügung. Die zinkabhängige Bindungsstelle kann entscheidend für die Aktivität des SAG sein. SAG, die zu einer Zinkbindung in der Lage sind, haben C-terminal das primäre Zinkbindemotiv H-X-D, bestehend aus den Aminosäuren Histidin (H), einer beliebigen (X) und Asparaginsäure (D). So ist beispielsweise bei den Superantigenen SPEC, SPEGGAS, SPEH, SPEJ und SMEZ die Zinkbindung an der polymorphen β-Kette der Klasse-II-MHC-Moleküle dominant. Die einzigen bisher bekannten Streptokokken-SAGs ohne Zinkbindung sind SSA und SPEA. Von den Staphylokokken-Enterotoxinen A (SEA) und E (SEE) weiß man,[5] dass sie beide Formen der Bindung kombinieren.
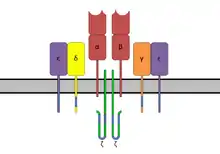
Interaktion mit Zielzellen
Die Interaktion mit den T-Zellen erfolgt im Wesentlichen über die CDR2- und HV4-Regionen der Vβ-Elemente des TCR, zum Teil unter geringfügigem Einfluss anderer variabler Regionen des TCR. Dies unterscheidet SAG in ihrer Bindung im Vergleich zu konventionellen Antigenen, die dafür die "complementarity determining region" (CDR) nutzen. Die Vβ-Elemente sind beim Menschen auf etwa 50 Gene beschränkt. Von diesen wird gegenwärtig (2005) für nur circa 24 Typen eine starke Interaktion mit SAG beschrieben. Dabei besitzen alle SAG ein spezifisches Profil an unterschiedlichen Erkennungssequenzen von Vβ-Elementen und binden somit unabhängig von der Antigenspezifität an jene T-Zellen, welche die entsprechenden Vβ-Elemente exprimieren. Das ermöglicht SAG mit 5 % bis 20 % aller T-Zellen zu interagieren, so dass es infolge zu einer Hyperproliferation kommt. Im Gegensatz dazu reagieren konventionelle Antigene mit 0,01 % bis 1 % aller T-Zellen.
Bei konventionellen Antigenen erfolgt nach ihrer exogenen Aufnahme zunächst eine Prozessierung in kleine Peptidfragmente von 9 bis 30 Aminosäuren innerhalb des lysosomalen Kompartiments des Phagosoms der antigenpräsentierenden Zelle. Nach Fusion von Phagosom und Endosom, das Klasse-II-MHC-Moleküle enthält, erfolgt die Präsentation der Antigenfragmente an der Zelloberfläche. Infolge wird eine spezifische und kontrollierte Immunreaktion mit Proliferation von T-Zellen, Ausstoß von Zytokinen und Antikörperbildung induziert. Superantigene hingegen sind unabhängig von Prozessierung und Präsentation und binden nicht in der Bindungsgrube, sondern direkt außerhalb an die DR- oder DQ-Domäne der Klasse-II-MHC-Moleküle der Antigen-präsentierenden Zellen (B-Zellen, Dendritische Zellen, Monozyten). Es findet keine MHC-Restriktion statt, wie sie typischerweise bei Peptid-Antigenen zu finden ist.
Folgen der Aktivierung
Durch die superantigen-vermittelte Aktivierung der APC und T-Zellen kommt es innerhalb der ersten Stunden zu massiven systemischen Lymphokinausstößen.[6] Dies führt zu einem Anstieg der Blutwerte der Zytokine IL-1, IL-2, IL-6, TNF-α, Gamma-Interferon (IFN-γ), macrophage inflammatory protein 1α (MIP-1α), MIP-1β und monocyte chemoattractant protein 1 (MCP-1).[6] Die Interaktion von SAG und Klasse-II-MHC-Molekülen führt zur Aktivierung von Phospholipase C und Proteinkinase C, gesteigerten Zytokingenexpressionen (IL-1, IL-12, TNF-α) und Phosphoinositol-Zusammenbruch. Die Aktivierung von T-Zellen führt über die Bildung von CD40 zu einem Klassenwechsel in B-Zellen.[7] Der abnormale Ausstoß von Lymphokinen scheint die Ursache für das Toxische Schock-Syndrom (TSS) und eine Reihe anderer Erkrankungen zu sein.[7]
Bakterielle Superantigene
Die meisten Superantigene werden von Bakterien gebildet, insbesondere grampositiven Bakterien.[8] Die Superantigene TSST (Toxic shock Syndrom Toxin) von Staphylococcus aureus und SPE (Streptokokken pyogenes Exotoxin) von invasiven Streptococcus pyogenes gelten für den Menschen weithin als Toxine mit hoher Letalität.[9] Circa 1 % der Staphylococcus aureus bilden das TSST-1, welches über Interleukin-1- und TNF-α-Freisetzung aus Makrophagen zum septischen Schock führt. Andere Stämme produzieren ein sogenanntes exfoliatives Toxin als SAG und verursachen damit bei Kleinkindern die Ritter-Krankheit (staphylococcal scalded skin syndrome, SSSS).[10] Streptokokken der Gruppen C und G wurden ebenfalls als potentielle Toxinbildner identifiziert, jedoch scheint sich deren Bedeutung auf Tiere zu beschränken. Unter den gramnegativen Mikroorganismen sind die Toxine MAM und YPM von Mycoplasma arthritidis bzw. Yersinia pseudotuberculosis als Superantigene identifiziert worden.
Virale Superantigene
Neben den bakteriellen Superantigenen werden superantigene Effekte bei Infektionen mit Viren der Herpes-Familie, dem Maus-Mammatumorvirus (MMTV), und dem humanen Immunschwächevirus 1 (HIV-1)[11][12] vermutet.
Bedeutung der Superantigene für den Mikroorganismus
Während Pathogene oftmals im Zuge einer Immunevasion eine Immunreaktion vermeiden, dient die Produktion von Superantigenen und die daraus folgende übermäßige dauerhafte Aktivierung von Immunzellen ebenfalls der Hinderung der adaptiven Immunreaktion. Vermutlich führt die superantigen-vermittelte Stimulation zum Verbrauch von lokal produzierten Interleukin-2 durch T-Zellen, wodurch eine effektive Immunantwort gegen Erreger unterdrückt wird. Der massive Zytokinausstoß führt vermutlich auch zu einer verzögerten spezifischen Erkennung des Pathogens, wodurch seine Ausbreitung erleichtert wird. Weiterhin können SAG eine Anergie und/oder Deletion von T-Zellen bewirken,[13] was ebenfalls zu einem effektiven Schutz des Erregers vor der adaptiven Immunantwort führt. Von den Streptokokken-Pyrogenen Exotoxin A und C und dem Staphylokokken-Enterotoxin B gibt es In-vitro-Studien, die belegen, dass diese Toxine die humorale Immunantwort in bestimmten Fällen unterdrücken können und somit auch die Bildung von Antikörpern unterbinden. Die Transkriptions-Regulation der Gene der Superantigene erfolgt oftmals durch die gleichen Faktoren wie die der Transkription der M-Proteine und Proteine der bakteriellen Kapsel.[14]
Die Verwicklung von Superantigen in Erkrankungen
Krankheiten, deren Assoziation zu Superantigenen vermutet wird
Verschiedene Anhaltspunkte weisen auf die Beteiligung von SAG an bestimmten Krankheiten hin oder werden sogar als deren Ätiologie in Betracht gezogen. Jedoch ist für viele Krankheiten die Rolle von SAG noch nicht bewiesen. Bei insulinabhängigem Diabetes mellitus wird eine Beziehung zum T-Zell-Superantigen IDDMK1,222 des Humanen-Endogenen-Retrovirus (HERV) K-18 und zu Enterotoxinen von S. aureus diskutiert. Ähnliches gilt für Autoimmunreaktionen wie rheumatische Endokarditis, Sjögren-Syndrom, akutes rheumatisches Fieber, rheumatoide Arthritis, Kawasaki-Syndrom und Multiple Sklerose, bei denen ein Zusammenhang mit bakteriellen SAG vermutet wird. Die pyrogenen Exotoxine A, C, G bis J, SSA und Varianten von SMEZ scheinen eine bedeutende Rolle bei akuter Tonsillitis, nekrotisierende Fasziitis, rheumatischem Fieber und Scharlach zu spielen. Die gleiche ungeklärte Rolle haben SAG beim plötzlichen Kindstod (SIDS), bei dem nach Autopsien auffällig oft Stämme von S. aureus, die pyrogene Exotoxine bilden, isoliert werden konnten. Es wird vermutet, dass SAG ebenfalls einen Einfluss bei einigen Hautkrankheiten wie dem atopischen Ekzem, atopischer Dermatitis und Psoriasis haben, da bei Patientenproben signifikant erhöhte Mengen an SAG isoliert werden konnten. Für SPE A und C konnte gezeigt werden, dass diese im Zusammenhang mit Psoriasis guttata stehen.
Krankheiten, die im Zusammenhang mit Superantigenen stehen
Unbestritten dagegen ist, dass die Enterotoxine A bis M und TSST-1 von S. aureus das toxische Schocksyndrom (TSS) mit nachfolgendem Multiorganversagen als auch diverse Lebensmittelvergiftungen (außer TSST-1) verursachen können. Gleiches gilt für Streptokokken-SAG, die auch pyrogene Exotoxine genannt werden und u. a. das Streptokokken-induzierte toxische Schocksyndrom sowie Scharlach (s. o.) verursachen.
Literatur
- Charles Janeway et al.: Immunobiology. 6. Auflage. ISBN 0815341016. Die 5. englische Ausgabe ist online auf den Seiten des NCBI-Bookshelf verfügbar, (online).
- Thomas Proft, John D. Fraser: Streptococcal Superantigens: Biological properties and potential role in disease, in: J. J. Ferretti, D. K. Stevens, V. A. Fischetti (Hrsg.): Streptococcus pyogenes: Basic Biology to Clinical Manifestations, 10. Februar 2016, University of Oklahoma Health Sciences Center; insbes. Tabelle 1
- Anastassios C. Papageorgiou, Carleen M. Collins, Delia M. Gutman, J. Bradford Kline, Susan M. O’Brien, Howard S. Tranter, K. Ravi Acharya: Structural basis for the recognition of superantigen streptococcal pyrogenic exotoxin A (SpeA1) by MHC class II molecules and T-cell receptors, in: EMBO J. 18(1), 4. Januar 1999, S. 9–21, doi:10.1093/emboj/18.1.9, PMC 1171097 (freier Volltext), PMID 9878045 (Allele SpeA1 bis SpeA4)
- Matthias Imöhl, Christina Fitzner, Stephanie Perniciaro, Mark van der Linden: Epidemiology and distribution of 10 superantigens among invasive Streptococcus pyogenes disease in Germany from 2009 to 2014, in: PLOS ONE, 18. Juli 2017, doi:10.1371/journal.pone.0180757
Einzelnachweise
- Patrick R. Murray, Ellen Jo Baron, Michael A. Pfaller, Fred C. Tenover, Robert H. Yolken: Manual of Clinical Microbiology. Hrsg.: American Society for Microbiology. 7th ed Auflage. ASM Press, Washington, D.C. 1999, ISBN 1-55581-126-4, S. 30.
- G. Ramachandran: Gram-positive and gram-negative bacterial toxins in sepsis: a brief review. In: Virulence. Band 5, Nummer 1, Januar 2014, S. 213–218, ISSN 2150-5608. doi:10.4161/viru.27024. PMID 24193365. PMC 3916377 (freier Volltext).
- C. Louis-Dit-Sully, B. Blumenthal, M. Duchniewicz, K. Beck-Garcia, G. J. Fiala, E. Beck-García, M. Mukenhirn, S. Minguet, W. W. Schamel: Activation of the TCR complex by peptide-MHC and superantigens. In: EXS. Band 104, 2014, S. 9–23, ISSN 1023-294X. doi:10.1007/978-3-0348-0726-5_2. PMID 24214615.
- R. Kaempfer, G. Arad, R. Levy, D. Hillman, I. Nasie, Z. Rotfogel: CD28: direct and critical receptor for superantigen toxins. In: Toxins. Band 5, Nummer 9, September 2013, S. 1531–1542, ISSN 2072-6651. doi:10.3390/toxins5091531. PMID 24022021. PMC 3798871 (freier Volltext).
- I. V. Pinchuk, E. J. Beswick, V. E. Reyes: Staphylococcal enterotoxins. In: Toxins. Band 2, Nummer 8, August 2010, S. 2177–2197, ISSN 2072-6651. doi:10.3390/toxins2082177. PMID 22069679. PMC 3153290 (freier Volltext).
- Stiles BG, Krakauer: Staphylococcal Enterotoxins: a Purging Experience in Review, Part I. In: Clinical Microbiology Newsletter. 27, 2005, S. 23.
- Jabara HH, Geha RS: The superantigen toxic shock syndrome toxin-1 induces CD40 ligand expression and modulates IgE isotype switching. In: Int. Immunol.. 8, Nr. 10, Oktober 1996, S. 1503–10. doi:10.1093/intimm/8.10.1503. PMID 8921429.
- A. R. Spaulding, W. Salgado-Pabón, P. L. Kohler, A. R. Horswill, D. Y. Leung, P. M. Schlievert: Staphylococcal and streptococcal superantigen exotoxins. In: Clinical microbiology reviews. Band 26, Nummer 3, Juli 2013, S. 422–447, ISSN 1098-6618. doi:10.1128/CMR.00104-12. PMID 23824366. PMC 3719495 (freier Volltext).
- Thomas Proft et al.: Superantigens and Streptococcal Toxic Shock Syndrome. Emerging Infectious Diseases 9, Okt. 2003, doi:10.3201/eid0910.030042.
- Klaus-Peter W. Schaps u. a. Hrg.: Das Zweite – kompakt: Grundlagen. Springer, 2008, ISBN 978-3540463443.
- Jean-François Fortin et al.: Hyper-responsiveness to stimulation of human immunodeficiency virus-infected CD4+ T cells requires Nef and Tat virus gene products and results from higher NFAT, NF-kappaB, and AP-1 induction. J Biol Chem. 278, Sept. 2004, S. 39520–31, doi:10.1074/jbc.M407477200.
- Satinder Dahiya et al.: Deployment of the human immunodeficiency virus type 1 protein arsenal: combating the host to enhance viral transcription and providing targets for therapeutic development, J Gen Virol 93, Juni 2012, S. 1151–1172, doi:10.1099/vir.0.041186-0.
- Lussow AR, MacDonald HR: Differential effects of superantigen-induced "anergy" on priming and effector stages of a T cell-dependent antibody response. In: Eur. J. Immunol.. 24, Nr. 2, Februar 1994, S. 445–9. doi:10.1002/eji.1830240227. PMID 8299694.
- Cleary PP, McLandsborough L, Ikeda L, Cue D, Krawczak J, Lam H: High-frequency intracellular infection and erythrogenic toxin A expression undergo phase variation in M1 group A streptococci. In: Mol. Microbiol.. 28, Nr. 1, April 1998, S. 157–67. doi:10.1046/j.1365-2958.1998.00786.x. PMID 9593304.