Strontiumranelat
Strontiumranelat, genauer Distrontiumranelat, ist das Strontiumsalz der Ranelicsäure und ein Arzneistoff zur Behandlung der Osteoporose. Strontium wird wie Calcium in die Knochen eingebaut. Die Ranelicsäure ermöglicht eine hohe Bioverfügbarkeit des Strontiums und hat selbst keinen Einfluss auf den Knochenmetabolismus.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
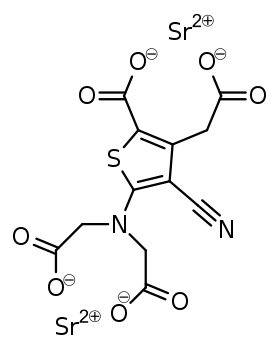 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Strontiumranelat | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C12H6N2O8SSr2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
M05BX03 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 513,49 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wirkung und Anwendungsgebiete
Die Einnahme von Strontiumranelat verringert das Risiko, einen Knochenbruch an der Wirbelsäule oder der Hüfte zu erleiden. Dieser Schutz ist für Frauen in allen betroffenen Altersgruppen nach der Menopause belegt.
Strontiumranelat hemmt den Knochenabbau und steigert gleichzeitig den Knochenaufbau. Das wirksame Agens ist das Strontium, wie Calcium ein Metall aus der Gruppe der Erdalkalimetalle. Es kann wie dieses als Bestandteil der Knochen eingebaut werden. Untersuchungen haben gezeigt, dass bei Osteoporosepatienten die radiologisch gemessene Knochendichte um 6,8 % gesteigert werden konnte, wenn sie mit Strontiumranelat behandelt wurden. Dabei geht allerdings etwa die Hälfte des Zuwachses auf die höhere Atommasse des Strontiums gegenüber dem in den Knochen enthaltenen Calcium zurück, während die andere Hälfte ein echter Zuwachs des Mineralgehaltes des Knochens ist. Klinische Untersuchungen sind über einen Behandlungszeitraum von bis zu 8 Jahren verfügbar.
Ranelicsäure selbst gilt als pharmakologisch inaktiv. Diese organische Säure ist sehr polar und wird kaum resorbiert, die orale Bioverfügbarkeit beträgt nur zirka 2,5 %. Ranelicsäure bewirkt eine günstige Pharmakokinetik und Verträglichkeit des Gegenions Strontium. Eine Anreicherung von Ranelicsäure wurde weder bei Tieren noch beim Menschen beobachtet.
Nebenwirkungen
Häufig treten Übelkeit und Durchfall (7 %) sowie Kopfschmerzen (3 %) unter Strontiumranelat auf.
Nach der Einführung in der EU 2004 wurden bis November 2007 16 Fälle von schweren Nebenwirkungen unter der Therapie mit Strontiumranelat gemeldet, davon 13 Fälle in Frankreich und 2 mit tödlichem Ausgang. Daraufhin haben die europäische und die französische Behörde die Aufnahme eines entsprechenden Warnhinweises in die Produktinformation angeordnet. Bei den Reaktionen handelt es sich um das so genannte DRESS-Syndrom (Drug Rash with Eosinophilia and Systemic Symptoms), eine schwerwiegende Reaktion des Immunsystems, die eines oder mehrere Organe betreffen kann, insbesondere Leber und Nieren. Gemäß den Fallberichten sind die Symptome DRESS-typisch innerhalb von 3 bis 6 Wochen nach Therapiebeginn aufgetreten. Dabei kam es zu Hautausschlägen, häufig begleitet von Fieber, Lymphadenopathie (Lymphknotenschwellungen) und einer Zunahme der Lymphozyten. Betroffen waren auch Lungen, Leber oder Nieren. In den meisten Fällen verbesserte sich der Zustand nach Absetzen des Arzneimittels und nach Einleitung einer Therapie mit Corticosteroiden.[2]
Zentralnervöse Nebenwirkungen wie Krampfanfälle, Bewusstseinsstörungen und Gedächtnisstörungen sind beschrieben.[3]
Auch ein Risiko für unter Umständen tödliche venöse Thromboembolien unter Strontium ist bekannt.[4] Protelos ist daher kontraindiziert bei Patienten mit akuten venösen Thromboembolien (VTE) oder VTE in der Vorgeschichte, einschließlich tiefer Venenthrombose und Lungenembolie sowie bei vorübergehender oder dauerhafter Immobilisierung aufgrund postoperativer oder sonstiger längerer Bettruhe.[5]
Im Mai 2013 wurden eine Einschränkung der Indikation sowie neue Kontraindikationen und Warnhinweise eingeführt, um das Risiko für unerwünschte kardiale Ereignisse zu reduzieren. Daten zur kardialen Sicherheit aus randomisierten klinischen Studien zu Strontiumranelat in der Behandlung der Osteoporose haben ein erhöhtes Risiko für Myokardinfarkte gezeigt, jedoch kein erhöhtes Risiko bezüglich der Mortalität.[6] Nach einem europäischen Risikobewertungsverfahren fordert die Europäische Arzneimittel-Agentur (EMA) weitere Anwendungseinschränkungen für Protelos aufgrund des erhöhten Risikos für Herzinfarkte und venöse Thrombose.[7]
2014 empfahl das BfArM den Einsatz auf Patienten zu beschränken, für die keine andere Therapie möglich ist.[8] Die Anwendungseinschränkungen aufgrund der revidierten Bewertung des Nutzen-Risiko-Verhältnisses haben dazu geführt, dass Strontiumranelat wegen zu geringer Nachfrage 2017 vom Markt genommen wurde.[9]
Handelspräparate
Eine Trockensuspension zum Einnehmen mit dem Wirkstoff Strontiumranelat ist unter den Handelsnamen Protelos und Osseor in Europa zugelassen für die „Behandlung der postmenopausalen Osteoporose zur Reduktion des Risikos von Wirbelsäulen- und Hüftfrakturen“.
Im August 2017 nahm Servier die Präparate weltweit vom Markt.[9][10]
Weblinks
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Strontiumranelat
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 3-(3-cyano-4-carboxymethyl-5-carboxy-2-thienyl)-3-azapentanedioic distrontium salt im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 12. Juli 2020.
- EMEA recommends changes in the product information for Protelos/Osseor due to the risk of severe hypersensitivity reactions. EMEA, 16. November 2007 (PDF; 42 kB).
- Strontiumranelat (Protelos). (PDF) In: Wirkstoff AKTUELL. Kassenärztliche Bundesvereinigung, Januar 2009, abgerufen am 11. Mai 2020.
- Prophylaxe, Diagnostik und Therapie der OSTEOPOROSE bei postmenopausalen Frauen und bei Männern. (PDF) In: Leitlinie des Dachverbands der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften. Dachverband Osteologie, 2017, abgerufen am 11. Mai 2020.
- Rote-Hand-Brief über neue Kontraindikationen für Strontiumranelat (Protelos) (PDF; 1,7 MB) abgerufen von WebSite der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ).
- Rote-Hand-Brief zur kardialen Sicherheit von Strontiumranelat (Protelos) (PDF; 1,5 MB) abgerufen von WebSite der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ).
- Medicines Agency recommends that Protelos/Osseor remain available but with further restrictions vom 21. Februar 2014.
- Servier Deutschland: Information für medizinisches/pharmazeutisches Fachpersonal: Neue eingeschränkte Indikation und Empfehlungen zu Kontrollen bei der Einnahme von Protelos (Strontiumranelat), 11. März 2014, abgerufen am 8. Juni 2017 (Rote-Hand-Brief).
- Endlich - Servier stellt Vertrieb von Strontiumranelat (PROTELOS) ein. arznei-telegramm 7. April 2017.
- Nachruf auf Protelos - Warum musste das Osteoporose-Mittel so früh von uns gehen? Deutsche Apotheker Zeitung 48/2017.