Strategies for Engineered Negligible Senescence
Strategies for Engineered Negligible Senescence (SENS, zu deutsch etwa „Strategien, um den Alterungsprozess mit technischen Mitteln vernachlässigbar zu machen“) ist ein Projekt des Biogerontologen Aubrey de Grey, das zum Ziel hat, die Schäden zu beheben, die wir Altern nennen. Für jede der bekannten Schadensklassen, die er die „sieben Todsünden des Alterns“ nennt, schlägt er Strategien zur Bekämpfung vor. Diese sieben Schadensklassen wurden im Zeitraum von 1907 bis 1982 entdeckt, seitdem sind keine neuen hinzugekommen.
Schadensklassen
Das von de Grey vorgeschlagene SENS-Verfahren basiert auf sieben von ihm propagierten Angriffspunkten. Als Angriffspunkte hat der Autor über die Lebensspanne allmählich anwachsende Veränderungen im Körper identifiziert, die nach rationalen Erwägungen und vorläufigen experimentellen Erkenntnissen als potenzielle Ursache für das Altern gelten können. Dabei ist, wie es auch in einem solch frühen Stadium der Erforschung vieler Krankheiten der Fall ist, nicht ganz klar, ob die beobachteten Veränderungen wirklich als primäre Ursachen fungieren, sekundäre Ereignisse sind oder sich von dem Krankheitsgeschehen eigentlich unabhängig entwickeln.[1]
- Bei Krebs (die tödlichste Folge von Mutationen)[2][3] bestehe die Strategie darin, Gentherapien zu nutzen, um die Gene für Telomerase zu löschen und Telomerase-unabhängige Mechanismen zu eliminieren, die normale Zellen in „unsterbliche“ Krebszellen verwandeln. Um den Verlust von Telomerase in den Stammzellen zu kompensieren, würden wir – je nach Gewebe – ungefähr jedes Jahrzehnt einmal frische Stammzellen zuführen.
- Bei Mitochondrienmutationen[4] ist geplant, sie nicht zu reparieren, sondern von den Mutationen ausgehenden Schaden zu verhindern, indem mittels Gentherapie modifizierte Kopien der Mitochondriengene in den Zellkern verlagert werden. Die mitochondriale DNA erfährt einen hohen Grad an Mutagenschäden, da die meisten freien Radikale in den Mitochondrien entstehen. Eine Kopie der mitochondrialen DNA im Zellkern wird besser vor freien Radikalen geschützt sein, und es wird eine bessere DNA-Reparatur stattfinden, wenn Schäden entstehen. Alle mitochondrialen Proteine würden dann in die Mitochondrien importiert.
- Zur Beseitigung intrazellularer Abfallstoffe[5] müssten neuartige Enzyme verwendet werden, welche möglicherweise aus Bodenbakterien gewonnen werden, die den Abfallstoff (Lipofuszin) abbauen können. Natürlicherweise im menschlichen Körper vorkommende Enzyme können diesen Stoff nicht abbauen.
- Extrazellulare Abfallstoffe (wie Amyloid)[6] könnten durch Impfungen beseitigt werden, die die Immunzellen dazu bringen, die Abfallstoffe zu „fressen“.
- Proteinvernetzung[7][8] könne größtenteils durch Medikamente rückgängig gemacht werden, die die Verbindungen aufbrechen. Doch um einige dieser Vernetzungen aufzubrechen, sei wahrscheinlich die Entwicklung enzymatischer Methoden nötig.
- Zellverlust[9] könne im Falle von Muskeln durch entsprechendes Training repariert (rückgängig gemacht) werden. Für andere Gewebearten würden diverse Wachstumsfaktoren benötigt, um die Zellteilung zu stimulieren, und in einigen Fällen würden Stammzellen gebraucht.
- Gealterte Zellen[10] könnten entfernt werden, indem das Immunsystem gegen sie gerichtet wird. Oder sie könnten durch Gentherapie vernichtet werden, indem „Suizid-Gene“ eingeschleust werden, die zielgerichtet gealterte Zellen abtöten.
Grundsätzlich wird von de Grey vorgeschlagen, diese Schäden nachträglich zu beseitigen, anstatt präventiv zu versuchen, einen möglichst schädigungsfreien Stoffwechsel zu etablieren. Unter anderem aus organisatorischen Gründen, da das „Altern an sich“ nicht als Krankheitsbild anerkannt ist und klinische Studien von den Zulassungsbehörden nicht genehmigt würden. Außerdem würde ein langfristiges, gewinnbringendes Eingreifen in vorhandene Stoffwechselprozesse des Körpers ein sehr tiefes und komplexes Wissen derer voraussetzten, über das man heute bei weitem nicht verfügt.
Die spezifischen Stoffwechselprozesse, die letztlich für die oben aufgelisteten Schadensklassen verantwortlich sind, werden eben nach wie vor nur teilweise verstanden. Doch wird derartig tiefgreifendes Wissen nicht unbedingt benötigt, um dem strukturellen Verfall mit entsprechenden Therapien entgegenzuwirken. Die Strategie für ihre Entfernung oder Reparatur sind entweder bereits in Form von Prototypen vorhanden oder es ist zu mindestens absehbar wie sie aus vorhandenen wissenschaftlichen Techniken entwickelt werden könnten. Doch auch nachdem diese (noch zu entwickelnden) neuen Therapien verwendet wurden, um alterndes Gewebe zu reparieren, werden Stoffwechselprozesse weiterhin neue Schäden verursachen. Dies bedeutet einfach, dass verjüngende Biotechnologien nicht eine einmalige Lösung ist, sondern vielmehr in regelmäßigen Abständen wiederholt werden muss, um die jugendliche Funktion von Gewebe, Organen und Körper zu bewahren. De Grey argumentiert, es mache keinen Sinn, die überwiegende Mehrheit unserer medizinischen Ressourcen für den Kampf gegen Alterskrankheiten auszugeben, ohne das Altern selbst zu bekämpfen.
Mutationen der Zellkern-DNA/Epimutationen
Durch Umweltgifte, Viren, Strahlung und Fehler bei der Zellteilung kommt es zu Veränderungen in der DNA des Zellkerns. Abgesehen von Krebserkrankungen, hätten diese Mutationen nach Ansicht de Greys innerhalb unserer heutigen Lebensspanne keinen relevanten Einfluss auf die Lebenserwartung. Die Mutationsrate in Zellen junger Menschen sei sehr gering, im Alter nehme sie um den Faktor zwei bis drei zu, der resultierende Wert sei aber aufgrund der niedrigen Basisgröße immer noch akzeptabel. In einer Zelle sind gewöhnlich angeblich nur 10 % der DNA aktiv, das bedeute, dass neun von zehn Veränderungen die Funktion der Zelle nicht beeinträchtigen. Sollte ein aktives Gen beschädigt worden sein, führe das gewöhnlich nur zu einer Verschlechterung aber nicht zu einem kompletten Erliegen des dazugehörigen Stoffwechselprozesses. Wichtig sei auch, dass sich die DNA-Veränderungen nur auf die eine, veränderte Zelle und deren durch Zellteilung erzeugten Abkömmlinge erstrecke.
Es wurde beobachtet, dass sich das epigenetische Profil in größeren Gewebestrukturen bei älteren Personen von denen jüngerer unterscheidet. Hauptsächlich ist eine Tendenz zu entzündungsfördernden und antioxidativen Aktivierung erkennbar. Die Art der Veränderungen und die weitgehende Homogenität der Wandlung im Gewebe lässt vermuten, dass es sich dabei um eine epigenetische Reaktion auf primär veränderte Umgebungsbedingungen handelt. Es sei dies also keine Ursache für das Altern, sondern ein sekundärer Prozess.
Krebserkrankungen
Die Behandlung von Krebserkrankungen hat immer ein grundsätzliches Problem: Durch die Gabe eines Tumor bekämpfenden Medikaments werden bei den allermeisten Patienten nicht 100 % der Krebszellen abgetötet, weil einige von ihnen nicht auf den Wirkstoff ansprechen. Die verbliebenen Zellen wachsen im weiteren Verlauf wieder zu einem Tumor heran, der aufgrund seiner vorherigen Auslese gegen das Medikament unempfindlich ist.[2][11]

Man müsste einen Wirkstoff entwickeln, der ein Ziel hat, das zwingend in jeder Krebszelle aktiv sein muss. Das Enzym Telomerase, welches die unbegrenzte Teilung der Krebszellen ermöglicht, indem es die für die Teilung notwendigen Telomere regeneriert, wäre ein potenzieller Angriffspunkt. Darüber hinaus müsste sichergestellt werden, dass jede Krebszelle von dem Wirkstoff erreicht wird. Dies ist nach Ansicht de Greys nur möglich, indem man durch eine Gentherapie nicht-selektiv in allen Körperzellen das Telomerase-Gen ausschaltet, welches außer in Krebszellen auch in gesunden Stammzellen aktiv ist.[12]
Dadurch würden die in verschiedenen Geweben vorhandenen Stammzellreserven mit der Zeit (ca. 10 Jahre), verbraucht und müssten therapeutisch ersetzt werden. Das Ersetzen von Stammzellen im Knochenmark ist beim Menschen bereits gut erprobt, ist aber nach wie vor mit hohen Risiken verbunden. Im Tierversuch konnte bereits erfolgreich die Regeneration der Hautoberfläche aus Stammzellen gezeigt werden. Diese ist darüber hinaus gut zugänglich und erscheint deshalb relativ leicht zu behandeln. Eine Stammzellversorgung der anderen Gewebe, in denen ebenfalls Stammzellen ersetzt werden müssten, wie das innere Lungengewebe oder im Gastro-Intestinal-Trakt stellt eine deutlich größere Schwierigkeit dar. Trotz des enormen Aufwands sieht de Grey diese Intervention als gerechtfertigt an, weil keine andere Methode zuverlässig in der Lage sei, Krebserkrankungen, die mit dem Alter immer stärker zunehmen, zuverlässig zu stoppen.
Mitochondriale Mutationen
In den Mitochondrien wird über eine Kette chemischer Vorgänge aus der Nahrung und Sauerstoff der universelle Energieträger ATP produziert. Teile der in diesem Prozess benötigten Proteine werden durch DNA codiert, die sich nicht – wie sonst üblich – im Zellkern, sondern in den Mitochondrien selbst befindet. Ihre lokale Verbindung zu dem Energiegewinnungsprozess, der mit der Entstehung freier Radikale verbunden ist sowie mangelnder chemischer Schutz und weniger effektive Reparaturmechanismen machen die Erbsubstanz für Mutationen anfällig.[13]
Beim Vergleich der Lebensspanne verschiedener Spezies gleicher Größe und Körpertemperatur ist eine Korrelation zwischen Lebensdauer und dem Grad der Mitochondrienmutation erkennbar. Freie Radikale und deren Wirken in den Mitochondrien werden mit diversen chronischen Erkrankungen (Altersdiabetes, Parkinson-Krankheit, Alzheimer-Demenz) in Verbindung gebracht.
Durch eine kalorienbegrenzte Diät kann die Lebensspanne von Modellorganismen erwiesenermaßen verlängert werden. Diese Beobachtung kann auf eine Veränderung des Stoffwechsels in den Mitochondrien – der in dieser Form weniger freie Radikale produziert – zurückgeführt werden.
Intrazelluläre Abfallprodukte
Tierische Zellen verfügen mit den Lysosomen über eine eigene Einrichtung zum Abbau nicht mehr benötigter Stoffe, die dort in wieder verwendbare Grundbausteine umgewandelt werden. Es werden Stoffe recycelt, die nur temporär gebraucht wurden und grundsätzlich nützlich sind, aber einen Defekt und giftige Verbindungen aufweisen. In einigen Fällen kann es passieren, dass Stoffe nicht oder nicht vollständig recycelt werden können; dieses sogenannte Lipofuscin (LF) sammelt sich dann als Abfallprodukt über die Lebensdauer in der Zelle an.[5]
In Studien an unterschiedlich lange lebenden Spezies konnte gezeigt werden, dass sich die LF-Pegel in den jeweiligen Lebensphasen (Jugend, Erwachsen, Alter) ähnelten, obwohl das kalendarische Alter in den Lebensphasen (zum Beispiel: Spezies 1 ist mit 2 Jahren erwachsen, Spezies 2 ist mit 3 Jahren erwachsen) unterschiedlich war. Bei der Zellteilung wird LF unter den beiden entstandenen Zellen aufgeteilt, was die Belastung reduziert. In dem sensiblen Gewebe von Herzmuskel und Gehirn findet diese Entlastung jedoch nicht statt, weil sich die Zellen dort nicht teilen. Große Mengen von LF führen zu einer verminderten Enzymmobilität und einem zu geringen Säuregrad in den Lysosomen, was den Umwandlungsprozess erschwert.
De Grey geht davon aus, dass intrazelluläre Ablagerungen durch LF in vielen Alterserkrankungen wie Arteriosklerose, Neurodegenerativen Erkrankungen und Makuladegeneration eine Rolle spielen.
Extrazelluläre Abfallprodukte
Im Laufe des Lebens sammeln sich bei jedem Menschen potenziell schädliche Abfallprodukte außerhalb unserer Zellen an. Bekanntestes Beispiel ist die Alzheimer-Krankheit, die durch die Bildung von sogenannten Amyloid-Plaques gekennzeichnet ist.[14]
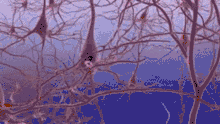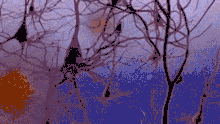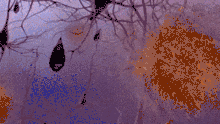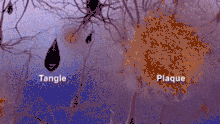
Potenziell tödlich verlaufende Erkrankungen können durch Ansammlungen im Herz-Kreislauf-System entstehen. Die Ablagerung der Proteinfibrillen um die Muskelfasern des Myokards verursacht hierbei eine Versteifung der Herzmuskulatur (Restriktive Kardiomyopathie). Dies führt über eine rasche Verschlechterung der Pumpleistung des Herzens zur Herzschwäche. Durch die Ablagerungen sind die Herzwände verdickt bei normaler oder verminderter Größe der Herzkammern. – Möglicherweise sind derartige krankhafte Veränderungen die Haupttodesursache bei Menschen, die älter als 110 Jahre alt werden.[15][16]
Proteinverkettung
Durch eine chemische Reaktionskette (Glykation oder Verbindung mit Triglyceriden) werden Proteine umlagert und neigen so zu Aneinanderlagerung und Kettenbildung. Diabeteskranke sind wegen der erhöhten Zuckerkonzentration im Blut verstärkt betroffen. Im cardiovaskulären System führt dies allgemein zu einer Verminderung der Elastizität und Flexibilität im Gewebe. Konkret bedeutet das eine reduzierte Pumpleistung des Herzens und durch die Verhärtung der Arterien ein Beitrag zum altersbedingten Anstieg des systolischen Blutdrucks – beides Risikofaktoren für einen Herzinfarkt. Mangelnde Elastizität im Gefäßsystem des Gehirns erhöht unter Belastung das Risiko für Hirnblutungen deutlich. Schäden durch Glykation treten darüber hinaus in Augen und Nieren auf; beide Organe sind bei Diabetikern besonders stark betroffen. Zu viele Verbindungen zwischen den Kollagenen lassen die Haut altern.[7][8]
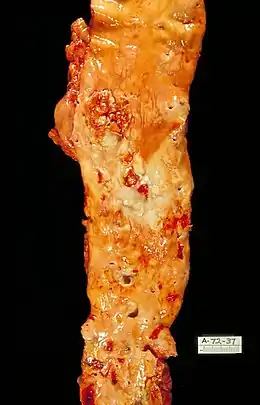
Studien zwischen verschiedenen Spezies und mehrerer Individuen einer Spezies zeigen eine inverse Korrelation zwischen maximaler Lebensdauer und dem Glykationsgrad bestimmter Proteine (Pentosidin). Beim Menschen konnte gezeigt werden, dass ein höherer Blutzuckerspiegel (auch innerhalb des Normbereichs) ein gesteigertes Sterblichkeitsrisiko – mit unterschiedlichen Auslösern – nach sich zieht. Beim Menschen scheinen die beiden veränderten Endprodukte Glucosepane (etwa zu 20 %) und K2P den größten Anteil beizusteuern.
Ersetzen von verlorenem Gewebe
Der menschliche Körper ist grundsätzlich in der Lage, geschädigtes Gewebe durch vorhandene adulte Stammzellen zu reparieren. Praktisch ist das Regenerationspotenzial allerdings begrenzt. Bei einem Schlaganfall konnte gezeigt werden, dass tatsächlich Stammzellen im Gehirn an die geschädigte Stelle wandern; dort sterben allerdings 80 % von ihnen innerhalb weniger Wochen ab. Die verbleibenden 20 % können nur 0,2 % des Schadens wiederherstellen. In Tiermodellen unterschiedlicher Krankheiten konnten embryonale Stammzellen das betroffene Gewebe zu einem deutlich höheren Grad erneuern. Ihr Teilungspotenzial ist signifikant größer, und sie sind in der Lage, alle Zelltypen hervorzubringen. Durch eine Regeneration des Thymus könnte die Leistungsfähigkeit des Immunsystems verbessert werden. Darüber hinaus haben Zelltherapien bei vielen altersbedingten Krankheiten wie Herzinfarkt, Schlaganfall, Parkinson und Makuladegeneration gute Erfolgsaussichten.[17]
Überflüssige Zellen
In verschiedenen Gewebearten des Körpers können Zelltypen entstehen, die zwar an sich nicht besonders gefährlich sind, aber nicht mehr optimal arbeiten oder durch übermäßiges Auftreten Prozesse negativ beeinflussen können. Zumindest belegen sie den Platz, an den normalerweise neue, gesunde Zellen treten würden.[10]
Das Immunsystem hat zu jeder gegebenen Lebensphase ein Kontingent an Zellen, die es unterhalten kann. Darunter ist das System der angeborenen Immunität, Zellen, welche die erworbene Immunität verkörpern und Gedächtniszellen, die eine schnelle Verteidigung gegen bekannte Antigene leisten. Bei chronischen Infektionen, die das Immunsystem nur zurückdrängen, aber nicht komplett eliminieren kann wie zum Beispiel bei Herpes Simplex, Herpes Zoster, oder dem Cytomegalievirus, kommt es zu einer permanenten Aktivität des Immunapparates gegen diese Erreger. Damit wird ein gewisses Kontingent im Immunsystem für diesen permanenten Stellungskampf verbraucht, der an anderer Stelle zu Defiziten führen kann. Es wurde beobachtet, dass mit der Zeit die Effektivität der Immunzellen sinkt, die mit einer chronischen Infektion beschäftigt sind. Darüber hinaus stehen die chronisch aktivierten Zellen der regulären Arbeit für andere Aufgaben des Immunsystems im Weg.
Fettgewebe ist nicht als reiner Energiespeicher zu sehen, sondern weist Funktionen wie ein Organ auf. Fettzellen stammen von den gleichen Vorläuferzellen ab wie Makrophagen und können entzündungsfördernde Botenstoffe wie TNF-Alpha oder IL-6 freisetzen. Die Beteiligung von Übergewicht an der Entstehung von schweren Erkrankungen wie zum Beispiel Diabetes ist gut untersucht, besonders ungünstig scheint dabei die übermäßige Anlagerung von Fettgewebe um die inneren Organe zu sein. Unterschiede in der Effektivität der Insulinverwertung zwischen älteren und jüngeren Menschen werden sehr viel geringer, wenn die Probanden beider Gruppen in Bezug auf die Menge von Organen umlagerndem Fett gleich sind. Umgekehrt hatten Fettabsaugungen, die nur subkutanes Fett entfernen, keinen positiven Einfluss auf die Insulinverwertung.
Nach mehreren Teilungen neigt sich der Lebenszyklus der Zelle dem Ende zu; am Ende eliminiert sich die Zelle in der Regel selbst. In einigen Fällen funktioniert dieser Mechanismus nicht und die gealterten Zellen versuchen mit allen Mitteln, die normale Funktion aufrechtzuerhalten. Dabei produzieren sie Stoffe wie EGF, MMPs, SDF1, VEGF, die in hoher Konzentration das Krebswachstum fördern könnten.
Im Jahre 2009 begründete Aubrey de Grey die SENS Foundation mit, um Fortschritte in den oben aufgelisteten Bereichen, sowohl durch Forschung, als auch durch öffentliche Fürsprache und den Kampf gegen Vorurteile, voranzutreiben.
Bisher erreichte Fortschritte bei der Reparatur von molekularen/zellulären Schäden
Zellverlust
Gealterte Zellen
Um diese unerwünschten Zellen auszuschalten, wird vorgeschlagen, sich moderner Verfahren zu bedienen, wie sie aus der Krebsmedizin bekannt sind. Wenn einzigartige Merkmale der auszuschaltenden Zellen gefunden werden, kann im Labor ein Arzneistoff entwickelt werden, der selektiv an diese Zellen bindet und nur dort seine Wirkung – in diesem Fall die Zerstörung der Zellen – entfaltet. Diese Verfahren sind wegen der genauen Selektion relativ arm an Nebenwirkungen und trotzdem sehr effektiv.
Im Labor von Dr. Janko Nikolich-Zugich an der Arizona University, wurde im Jahr 2010 die Beziehung zwischen persistenten Virusinfektionen und Immunoseneszenz erforscht und T-Zellen von jungen ausgewachsenen Mäuse in älteren Mäusen verpflanzt, denen man einen Teil ihres eigenen senszenten T-Zellen entfernt hatte.[18]
Proteinvernetzung/Glykation
Ein indisches Unternehmen namens Torrent Pharmaceuticals entwickelt seit einiger Zeit (2006) einen Molekülcocktail um AGEs aufzubrechen und die mit Diabetes einhergehenden vaskulären und geweblichen Verklebungen zu beseitigen.[19]
Der Wirkstoff Alagebrium, der durch Abbau dieser Verkettungen die Leistungsfähigkeit des Herz-Kreislaufsystems verbessern sollte, zeigte in einer Vielzahl von Studien an unterschiedlichen Versuchstieren ermutigende Resultate. Durch Abbau von Alpha-Diketone konnte die Flexibilität des Gewebes und klinische Parameter wie Blutdruck und die Pumpleistung des Herzens verbessert werden. Leider konnten diese hoffnungsvollen Resultate in klinischen Studien am Menschen nicht bestätigt werden.
Aubrey de Grey vermutet, dass methodische Mängel bei der Gewebeanalyse und eine andere Zusammensetzung der veränderten Endprodukte in unterschiedlich lange lebenden Spezies dafür verantwortlich sind.
Extrazelluläre Abfallstoffe
In Versuchen an verschiedenen Tiermodellen konnte gezeigt werden, dass eine Impfung gegen Amyloid effektiv und sicher ist. Erste klinische Studien am Menschen mussten allerdings vorzeitig abgebrochen werden, weil es zu schweren Entzündungen im Gehirn der Patienten kam. Passives Impfen, also die regelmäßige direkte Verabreichung der gewünschten Antikörper, könnte eine Lösung bieten, genauso wie das aktive Immunisieren gegen nur Teilelemente des Amyloids.
Nachdem Therapien erfolgreich die Ansammlung von Amyloid-β im Gehirn beseitigen konnten, konzentriert sich Forschung jetzt (Dezember 2013) auf hyperphosphoryliertes Tau.[20]
Intrazelluläre Abfallstoffe
In Laborversuchen konnten Bakterien isoliert werden, die Lipofuscin abbauende Enzyme bilden. Diese Enzyme könnten in Tablettenform oder als Infusion verabreicht werden oder durch Gentherapie direkt in den Zellen hergestellt werden.
In Tierversuchen an Mäusen konnte gezeigt werden, dass die Funktionsfähigkeit der Leber älterer Tieren wesentlich (bis zum Niveau von jungen Mäusen) verbessert werden konnte, indem man im Alter die Anzahl der Rezeptoren auf der Leberzell-Oberfläche erhöhte, an die Chaperone andocken können.[21]
Mitochondrienmutationen
In Versuchen an Mäusen aus dem Jahr 2005 wurde ein zusätzliches Gen für das antioxidative Enzym Catalase an verschiedene Stellen implementiert. Die Aufnahme des zusätzlichen Gens in den Zellkern veränderte die Lebenserwartung nicht. Durch Einbau in die Mitochondrien konnten jedoch Schäden an deren Erbsubstanz verringert und die maximale Lebensdauer der Tiere um etwa 20 % erhöht werden.
Zur Erhaltung des eigenen Stoffwechsels wird in veränderten Mitochondrien über das Plasma-Membran-Redox-System NADH zu NAD+ umgewandelt. Dabei kommt es zu einer Abgabe von überschüssigen Elektronen in den extrazellulären Bereich, wo andere, langlebigere Moleküle wie zum Beispiel das LDL-Cholesterin oxidiert werden können.
Im Jahr 2011, etablierten die Forscher Dr. Matthew ‚Oki‘ O’Connor und Dr. Gayathri Swaminathan in den Laboren der SENS Foundation mehrere stabile Zellkulturen, für jedes der fünf modifizierten mitochondrialen Gene, mit denen sie arbeiten.[22]
Mutationen im Zellkern
Die SENS Foundation finanziert Forschung am Albert Einstein College of Medicine um die Rate mit der Epimutationen angesammelt werden genau zu bestimmen, um in einem weiteren Schritt gegen die Mutationen vorgehen zu können, bevor sie Krebs hervorrufen.[23]
Gleichzeitig wurde im hauseigenen Labor der SRF im Februar 2012 damit begonnen, molekulare Ziele (sog. Mediatoren) zu identifizieren, um die alternative Telomerverlängerung (neben Telomerase) in kanzerösen Tumoren abzuschalten.[24]
Weblinks
- SENS Foundation (en)
- Fight Aging! – eine Website, die neue Erkenntnisse im Bereich Altern und Verjüngung kommentiert (en)
- Regenerative Medizin und Verjüngung (en)
- Ressourcen und Artikel über die Biologie des Alterns und Lebensverlängerung (en)
- Die Biogerontology Research Foundation – ein englischer Wohlfahrtsverband, der sich auf Verjüngung konzentriert (en)
- Aging Cell – ein Onlinemagazin, das sich mit neuen Verjüngungsstrategien beschäftigt (en)
Einzelnachweise
- Aubrey de Grey, Michael Rae: Niemals Alt! So lässt sich das Altern umkehren. Fortschritte der Verjüngungsforschung. Transcript Verlag, Bielefeld April 2010, ISBN 978-3-8376-1336-0.
- Szilard L: ON THE NATURE OF THE AGING PROCESS. In: Proc. Natl. Acad. Sci. U.S.A.. 45, Nr. 1, Januar 1959, S. 30–45. PMID 16590351. PMC 222509 (freier Volltext).
- Cutler RG: The dysdifferentiation hypothesis of mammalian aging and longevity. In: Giacobini E, et al. (Hrsg.): The Aging Brain: Cellular and Molecular Mechanisms of Aging in the Nervous System (= Aging), Band 20. Raven, New York 1982, ISBN 0-89004-802-9, S. 1–19, OCLC 8473401.
- Harman D: The biologic clock: the mitochondria?. In: J Am Geriatr Soc. 20, Nr. 4, April 1972, S. 145–7. PMID 5016631.
- STREHLER BL, MARK DD, MILDVAN AS: GEE MV: Rate and magnitude of age pigment accumulation in the human myocardium. In: J Gerontol. 14, Oktober 1959, S. 430–9. PMID 13835175.
- A. Alzheimer: Über eine eigenartige Erkrankung der Hirnrinde.. In: Allg. Z. Psychiat. Psych.-Gerichtl. Med.. 64, Nr. 1–2, 1907, S. 146–148.
- MOVAT HZ, MORE RH, HAUST MD: The diffuse intimal thickening of the human aorta with aging. In: Am. J. Pathol.. 34, Nr. 6, 1958, S. 1023–31. PMID 13583094. PMC 1934788 (freier Volltext).
- Monnier VM, Cerami A: Nonenzymatic browning in vivo: possible process for aging of long-lived proteins. In: Science. 211, Nr. 4481, Januar 1981, S. 491–3. PMID 6779377.
- BRODY H: Organization of the cerebral cortex. III. A study of aging in the human cerebral cortex. In: J. Comp. Neurol.. 102, Nr. 2, April 1955, S. 511–6. PMID 14381544.
- HAYFLICK L: THE LIMITED IN VITRO LIFETIME OF HUMAN DIPLOID CELL STRAINS. In: Exp. Cell Res.. 37, März 1965, S. 614–36. PMID 14315085.
- Cutler RG: The dysdifferentiation hypothesis of mammalian aging and longevity. In: Giacobini E, et al. (Hrsg.): The Aging Brain: Cellular and Molecular Mechanisms of Aging in the Nervous System (= Aging), Band 20. Raven, New York 1982, ISBN 0-89004-802-9, S. 1–19, OCLC 8473401.
- G. Witzany: The viral origins of telomeres and telomerases and their important role in eukaryogenesis and genome maintenance.. In: Biosemiotics. 1, 2008, S. 191–206. doi:10.1007/s12304-008-9018-0.
- Harman D: The biologic clock: the mitochondria?. In: J Am Geriatr Soc. 20, Nr. 4, April 1972, S. 145–7. PMID 5016631.
- A. Alzheimer: Über eine eigenartige Erkrankung der Hirnrinde.. In: Allg. Z. Psychiat. Psych.-Gerichtl. Med.. 64, Nr. 1–2, 1907, S. 146–148.
- Coles LS, Young RD: Supercentenarians and transthyretin amyloidosis: the next frontier of human life extension. In: PREVENTATIVE MEDICINE. 54, Nr. Suppl, 2012, S. s9-s11. doi:10.1016/j.ypmed.2012.03.003. PMID 22579241.
- Searching for the Secrets of the Super Old. Science. S. 1764–65. 26. September 2008. Abgerufen am 22. Februar 2013.
- „Stammzelltherapie für Querschnittsgelähmte“, 13. Oktober 2010
- SRF End of Year Report 2010. Abgerufen am 26. Oktober 2014.
- AGE Breakers Beyond Alagebrium. Abgerufen am 26. Oktober 2014.
- Ezio Giacobini, Gabriel Gold: Alzheimer disease therapy—moving from amyloid-β to tau. In: Nature Reviews Neurology. Band 9, Nr. 12, Dezember 2013, S. 677–686, doi:10.1038/nrneurol.2013.223.
- Die Anti-Ageing-Müllabfuhr. Auf: wissenschaft.de vom 11. August 2008.
- SRF End of Year Report 2011. Abgerufen am 26. Oktober 2014.
- Epimutations at Albert Einstein College of Medicine. Abgerufen am 26. Oktober 2014.
- Making cancerous mutations harmless. Abgerufen am 26. Oktober 2014.