Stammzelltherapie
Als Stammzelltherapie werden Behandlungsverfahren bezeichnet, bei denen Stammzellen eingesetzt werden. Sie findet schon seit vielen Jahren bei der Behandlung verschiedener Krebserkrankungen, wie zum Beispiel bei Leukämien[1], Anwendung. Diese Indikationen sind unter dem Stichwort Stammzelltransplantation beschrieben.
Bei diesen Therapien werden für den adoptiven Zelltransfer entweder körpereigene hämatopoetische Stammzellen oder die eines Spenders verwendet. Diese multipotenten Blutstammzellen, aus denen sowohl Kolonien aus weißen als auch von roten Blutkörperchen gezüchtet werden konnten, wurden bereits 1963 von den kanadischen Wissenschaftlern James Till, Ernest McCulloch und Louis Siminovitch entdeckt.[2] Bereits einige Jahre zuvor wurde 1957 die erste Knochenmarkstransplantation durchgeführt[3].
Seit den 1990er Jahren wurden jedoch viele weitere Stammzellen entdeckt, isoliert und charakterisiert. Bis heute ist nicht ausreichend geklärt, wie die einzelnen Typen von Stammzellen in Verbindung stehen und welches biologische Potenzial sie haben. Gerade in den letzten Jahren sind jedoch vielfältige Entdeckungen auf diesem Gebiet gemacht worden und es sind mit der Biomedizin ganz neue und vielversprechende Felder in der medizinischen Forschung eröffnet worden.
Allgemeines zum therapeutischen Einsatz von Stammzellen
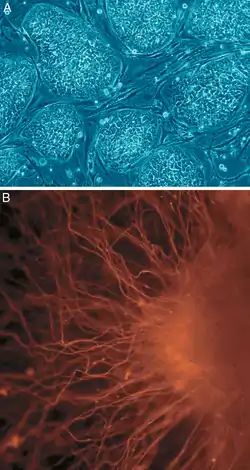
Stammzellen können zum einen aus embryonalem (pränatalem) Gewebe, zum anderen aus adultem (postnatalem) Gewebe isoliert werden. Embryonale Stammzellen sind pluripotent, während adulte Stammzellen vermutlich ein eingeschränkteres Differenzierungspotential besitzen. Allgemein gilt, dass, je fortgeschrittener das Entwicklungsstadium eines Organismus ist, die aus diesem isolierten Stammzellen eine umso geringere Teilungsrate und ein umso eingeschränkteres Differenzierungspotential besitzen. Eine hohe Teilungsrate wäre wichtig, um etwa genug Zellen für eine Therapie zur Verfügung zu haben, ein breites Differenzierungspotential erlaubt mehr Behandlungsmöglichkeiten.
Ein Großteil der wissenschaftlichen Untersuchungen an Stammzellen wird in vitro, also mit isolierten und in speziellen Nährmedien kultivierten Stammzellen, oder in vivo an Versuchstieren durchgeführt. Die Forschung beschäftigt sich derzeit noch mit grundlegenden Fragen, etwa, wie diese Stammzellen dazu gebracht werden können, in ganz bestimmte Zelltypen zu differenzieren, um etwa ein geschädigtes Gewebe damit zu ersetzen (Zellersatztherapie). Andere Fragestellungen umfassen das Migrationsverhalten (die Wanderung der Zellen an einen bestimmten Ort nach erfolgreicher Transplantation) oder die Bildung zellprotektiver Faktoren (Zytokine, Wachstumsfaktoren), die noch vorhandenes funktionelles Gewebe vor weiterem Untergang bewahren oder sogar regenerieren sollen (Regenerative Medizin).
Pränatale Stammzellen und Therapiemöglichkeiten
Embryonale Stammzellen haben in den letzten Jahren viele ethische, aber auch wissenschaftliche Bedenken ausgelöst (→ Embryonale Stammzellen). Obwohl sie in fast alle Körperzellen differenziert werden können (und somit universell einsetzbar wären), ist ihre Verwendung vorerst eingeschränkt. Dies ist nicht zuletzt in ihrer hohen Zellteilungsrate begründet, die zwar zur Vermehrung der Zellen wünschenswert ist, aber gleichzeitig ein erhöhtes Risiko für die Entstehung bösartiger Tumoren darstellt.
Stammzellen, die einem späteren Stadium des Fetus entstammen, haben eine geringere Teilungsrate und ein eingeschränkteres Differenzierungspotential (je nachdem, aus welchem Bereich des Fötus sie isoliert wurden). Sie führten in Tierversuchen aber zur Verbesserung einiger Krankheitsbilder und wurden bereits an über 300 Parkinson-Patienten weltweit mit einigem Erfolg getestet, auch wenn sie aufgrund schwerer Nebenwirkungen sowie ethischer Bedenken vorerst kaum mehr Verwendung finden.
Stammzellen aus der Gebärmutterflüssigkeit wurden erst vor kurzem isoliert. Sie sind Zellen meist epithelialen Ursprungs, die sich während der Entwicklung des Fötus von diesem ablösen. Sie können direkt aus dem Fruchtwasser gewonnen werden und können in vitro vermehrt werden.[4]
Andere, eigentlich „frühe adulte“ (postnatale), Stammzellen können aus dem Nabelschnurblut isoliert werden. Sie sind schon länger bekannt, über ihre Verwendung wird gegenwärtig intensiv geforscht (→ Nabelschnurblutstammzellen).
Ethische Bedenken in ähnlicher Weise wie bei embryonalen Stammzellen würden bei Verwendung dieser beiden Zellen entfallen, und da sie dem Organismus zu einem relativ frühen Stadium entnommen werden, haben sie vermutlich ein breites Differenzierungspotential.
Seit April 2011 laufen die einzigen zwei von der US-amerikanischen Food and Drug Administration (FDA) genehmigten Patientenversuche.[5] Hier werden ältere Patienten mit trockener Makuladegeneration (AMD) und jüngere Patienten mit Morbus Stargardt mit Zellen des retinalen Pigmentepithels (RPE) behandelt, d. h. ihnen werden 50–200.000 RPE-Zellen in die Netzhaut eines Auges injiziert. Diese Zellen werden aus embryonalen Stammzellen gewonnen, ohne dass ein Embryo zerstört wird (patentierte Blastomeretechnik, ähnlich der PID-Diagnostik). Mittlerweile sind über 40 Patienten in vier Augenkliniken der USA und zwei in Großbritannien behandelt worden. Im Oktober 2014 erschien in The Lancet ein Peer-Review Artikel.[6] Ihm zufolge habe die Mehrzahl der Patienten signifikante Sehverbesserungen aufgewiesen. Das hat die FDA dazu bewogen, auch für jüngere Patienten eine Versuchsreihe zu genehmigen. Grundsätzlich beginnen solche Versuche mit älteren Patienten, die schon eine fortgeschrittene Erkrankung ihrer Sehleistung haben. Vorrangig geht es um die sichere Verwendung der Therapie.
Adulte Stammzellen und Therapiemöglichkeiten
Neuronale Stammzellen, die vor allem aus den Ventrikelwänden des Gehirns isoliert werden, können in die drei Haupttypen neuraler Zellen (Nervenzellen sowie Astro- und Oligodendrogliazellen) differenziert werden. Sie wären für eine Therapie neurodegenerativer Erkrankungen prinzipiell geeignet, da sie Nervengewebe theoretisch ersetzen können. Jedoch sind diese Zellen im Organismus nur in geringem Ausmaß vorhanden und haben eine geringe Teilungsrate. Darüber hinaus stellt das Zentralnervensystem ein überaus komplexes Gewebe dar, das einen Gewebeersatz sehr schwierig macht.
Stammzellen aus dem Mesenchym werden v. a. aus dem Knochenmark gewonnen, sogar aus jenem älterer Menschen, haben eine hohe Teilungsrate und können primär in Gewebszellen mesenchymalen Ursprungs (Knochen, Knorpel, Sehnen, Muskel, Bindegewebe, Blutzellen) differenzieren. Sie könnten somit direkt der Behandlung degenerativer Erkrankungen dieser Organe dienen. Seit etwa dem Jahr 2000 werden vermehrt Versuche unternommen, diese Zellen auch in Zelltypen anderer Gewebe zu differenzieren (Transdifferenzierung), etwa Nervenzellen, Leber-, Epithel-, β-Zellen und zellen, um sie auf ihr therapeutisches Potential entsprechender Erkrankungen in diesem Bereich hin zu untersuchen. Studien hinsichtlich der Knochenregenerierung mithilfe der mesenchymalen Stammzellen aus Nabelschnurblut zeigen erste Erfolge.[7]
Weitere adulte Stammzellen finden sich in Muskeln, Leber, Fett- und Knochengewebe u.v. a. Auch ihre Verwendungsmöglichkeiten werden untersucht. Ein genereller Vorteil adulter Stammzellen liegt darin, dass sie im Prinzip autolog transplantiert werden könnten, d. h. der Spender z. B. mesenchymaler Stammzellen wäre, nach entsprechender Vorbehandlung der Zellen, gleichzeitig ihr Empfänger (etwa im Rahmen einer neurodegenerativen Erkrankung).
Mögliche Risiken und Nebenwirkungen einer Stammzelltherapie
Die oben beschriebenen Versuche sind, je nach Krankheitsmodell (etwa, ob es sich um einen lokalen organischen Schaden oder eher um eine systemische Erkrankung handelt), therapeutisch vielversprechend. Nicht zuletzt deswegen lassen sich immer mehr Patienten mit einer tödlichen Erkrankung oder einer irreparablen Schädigung, etwa nach Querschnittlähmung, einer solchen „experimentellen“ Behandlung unterziehen, deren Ausgang jedoch völlig ungewiss ist.
Derzeit wird nur in wenigen Fällen eine Transplantation von Stammzellen durchgeführt (siehe Einleitung). Diese Therapien sind über lange Jahre bis Jahrzehnte im Rahmen kontrollierter klinischer Studien erprobt worden und kamen nur zur Anwendung, weil sie sich
- als effektiv erwiesen und
- der therapeutische Nutzen die möglichen Nebenwirkungen überwiegt.
Zu mesenchymalen Stammzellen beispielsweise, die erst vor wenigen Jahren entdeckt wurden, liegen zahlreiche Tierstudien vor, deren Ergebnisse für die Wirksamkeit der Behandlung sprechen. Gegenwärtig wird im Rahmen klinischer Studien ihre Wirksamkeit im Menschen untersucht,[8] so dass diese Zellen als Arzneimittel für neuartige Therapien zugelassen werden könnten.[9][10]
Anwendung der Stammzellentherapie im Leistungssport
Bei Muskelverletzungen im Spitzensport wird größter Wert auf schnellstmögliche Wiederherstellung gelegt, da der Ausfall von einzelnen Sportlern/Spielern mit erheblichen Nachteilen verbunden ist – und Spitzensport ohnehin mit großen gesundheitlichen Risiken verbunden ist. Während in Deutschland der Einsatz der Stammzelltherapie noch weit zurückhängt (und damit nach Erhebungen der UEFA die Verletzungsdauer bei Spielern der europäischen Vereinswettbewerben überdurchschnittlich lange dauert[11]), ist diese z. B. in Spanien im Spitzensport weit verbreitet.[12] Pep Guardiola hat daher auch andere Behandlungsmethoden beim FC Bayern eingefordert.[13] Die kürzesten Regenerationszeiten nach Muskelverletzungen scheint bisher die Stammzelltherapie zu haben, wenn man sie mit der hyperbaren Therapie kombiniert. So ließen sich bei südafrikanischen Spitzenrugbyspieler die Regenerationszeiten nach Muskelverletzungen um mehr als ein Drittel reduzieren.[14]
Risiken des „Stammzelltourismus“
Viele Patienten mit einer schweren, tödlichen Erkrankung erhoffen sich eine erfolgreiche Behandlung in Privatkliniken, die ihnen Heilung durch eine oft risikoreiche Anwendungsart (z. B. Injektion ins Gehirn) von wissenschaftlich undefinierten Stammzellen versprechen. Meist sind diese Kliniken in Staaten beheimatet, die weniger strenge Auflagen an experimentelle Therapien am Menschen haben (etwa in China, der Ukraine, der Türkei), aber auch in Westeuropa (z. B. in den Niederlanden). Patienten bringen sich durch Zahlung hoher Summen für eine Behandlung (beispielsweise 20.000–50.000 € pro Behandlung) oft in die Nähe des finanziellen Ruins, obwohl eine Aussicht auf Erfolg gering oder nicht einschätzbar sind. Bis heute gibt es keine fundierten Berichte darüber, dass ein Mensch durch eine solche Stammzelltherapie vollständig genesen sei, noch der Krankheitsverlauf wesentlich verlangsamt worden wäre. Die behandelnden Privatkliniken erheben bzw. veröffentlichen meistens keine wissenschaftlich gültigen Informationen, die Aufschluss über die Wirksamkeit der Behandlung geben. Entsprechend gibt es kaum Studien über mögliche Nebenwirkungen, vor allem bei systemischer Gabe der Zellen.[15] In Einzelfällen, bei denen es möglich war, die Patienten vor und nach der Transplantation zu beobachten, wurden Nebenwirkungen beobachtet (etwa Meningitis nach Transplantation eines Gemisches von fötalen Gehirnzellen ins Rückenmark).[16]
2009 wurde ein Fall eines Jungen mit Louis-Bar-Syndrom bekannt, welcher in Russland mit Injektionen eines Gemisches von fötalen Gehirnzellen (die möglicherweise Stammzellen enthalten) in Gehirn und Rückenmark behandelt worden war. Aus diesem Zellgemisch entwickelten sich anschließend mehrere Tumoren in Kleinhirn und Rückenmark.[17]
Um Patienten vor unseriösen, möglicherweise schädigenden Stammzell-Behandlungen zu schützen bzw. über diese aufzuklären, hat die Internationale Gesellschaft für Stammzell-Forschung eine Patientenbroschüre erstellt.[18]
Quellen
- H.-D. Peters, R. Kath: Neue therapeutisch aktive monoklonale Antikörper gegen Leukämien und Lymphome. In: Der Onkologe. Band 7, Nr. 2, 19. Februar 2001, ISSN 0947-8965, S. 196–199, doi:10.1007/s007610170158 (springer.com [abgerufen am 19. September 2018]).
- A. D. Ho, K. Beyreuther: Faszinierende Multitalente – "Rohstoff" Stammzellen? In: Ruperto Carola. Nr. 3, 2001, Universitätsklinikum Heidelberg
- IOP e.V. (Berlin): Die Geschichte der Transplantation (Memento vom 27. Juni 2009 im Internet Archive)
- Patrizia Bossolasco, Tiziana Montemurro, Lidia Cova, Stefano Zangrossi, Cinzia Calzarossa, Simona Buiatiotis, Davide Soligo, Silvano Bosari, Vincenzo Silani, Giorgio Lambertenghi Deliliers, Paolo Rebulla, Lorenza Lazzari: Molecular and phenotypic characterization of human amniotic fluid cells and their differentiation potential. In: Cell Research. Band 16, Nr. 4, 2006, ISSN 1001-0602, S. 329–336, doi:10.1038/sj.cr.7310043, PMID 16617328.
- ongoing-clinical-trials (Memento des Originals vom 31. März 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.. Website von OCATA Therapeutics. Abgerufen am 28. März 2015.
- Steven D. Schwartz u. a.: Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. In: The Lancet. Band 385, Nr. 9967, 2015, S. 509–516, doi:10.1016/S0140-6736(14)61376-3.
- M. Jäger, M. Sager, A. Knipper, Ö. Degistirici, J. Fischer: In-vitro- und In-vivo-Knochenregenerierung durch mesenchymale Stammzellen aus dem Nabelschnurblut. In: Der Orthopäde. Band 33, Nr. 12, Dezember 2004, ISSN 0085-4530, S. 1361–1372, doi:10.1007/s00132-004-0737-x (springer.com [abgerufen am 19. September 2018]).
- Alan Trounson, Rahul G. Thakar, Geoff Lomax, Don Gibbons: Clinical trials for stem cell therapies. In: BMC Medicine. Band 9, 2011, S. 52, doi:10.1186/1741-7015-9-52, PMID 21569277.
- Siegmund Lang, Gero Brockhoff, Boyko Gueorguiev, Michaela Huber, Johannes Zellner: Modifikation der Zentrifugation zur Reduktion der Leukozytenzahl in Platelet-rich Plasma und die Auswirkung auf die Proliferation von autologen mesenchymalen Stammzellen. In: Sports Orthopaedics and Traumatology Sport-Orthopädie - Sport-Traumatologie. Band 32, Nr. 2, Juni 2016, ISSN 0949-328X, S. 177–182, doi:10.1016/j.orthtr.2016.02.001.
- B. Suvandzhieva, S. Böhm, P. Moretti, T. Scheper, C. Kasper: Auswirkung mechanischer Stimulation auf die osteogene Differenzierung von humanen mesenchymalen Stammzellen. In: Chemie Ingenieur Technik. Band 82, Nr. 9, 27. August 2010, ISSN 0009-286X, S. 1562–1562, doi:10.1002/cite.201050078.
- Anna Hallén, Jan Ekstrand: Return to play following muscle injuries in professional footballers. In: Journal of Sports Sciences. Band 32, Nr. 13, 2014, ISSN 1466-447X, S. 1229–1236, doi:10.1080/02640414.2014.905695, PMID 24784885.
- Pura Muñoz-Cánoves, Jaime J. Carvajal, Adolfo Lopez de Munain, Ander Izeta: Editorial: Role of Stem Cells in Skeletal Muscle Development, Regeneration, Repair, Aging, and Disease. In: Frontiers in Aging Neuroscience. 2016, S. 95, doi:10.3389/fnagi.2016.00095.
- Arnd Krüger: Pep Guardiola. In: Leistungssport. 46, 4, 2016, S. 27–28.
- D. M. Botha, Y. Coopoo, M. K. Botha u. a.: The effect of hyperbaric oxygen and blood platelet injection therapy on the healing of hamstring injuries in rugby players: a case series report. In: African Journal for Physical, Health Education, Recreation and Dance. Supplement 1, November 2015, S. 29–39.
- Martin Enserink: Selling the Stem Cell Dream. In: Science. Band 313, Nr. 5784, 2006, S. 160–163, doi:10.1126/science.313.5784.160.
- Bruce H. Dobkin, Armin Curt, James Guest: Cellular Transplants in China: Observational Study from the Largest Human Experiment in Chronic Spinal Cord Injury. In: Neurorehabilitation and neural repair. Band 20, Nr. 1, 2006, ISSN 1545-9683, S. 5–13, doi:10.1177/1545968305284675, PMC 4169140 (freier Volltext).
- Ninette Amariglio, Abraham Hirshberg, Bernd W. Scheithauer, Yoram Cohen, Ron Loewenthal, Luba Trakhtenbrot, Nurit Paz, Maya Koren-Michowitz, Dalia Waldman, Leonor Leider-Trejo, Amos Toren, Shlomi Constantini, Gideon Rechavi: Donor-Derived Brain Tumor Following Neural Stem Cell Transplantation in an Ataxia Telangiectasia Patient. In: PLoS Medicine. Band 6, Nr. 2, 2009, S. e1000029, doi:10.1371/journal.pmed.1000029.
- Internationale Gesellschaft für Stammzell-Therapie - Patientenhandbuch zur Stammzelltherapie (PDF; 304 kB).