KC8
KC8 ist ein bronzefarbener Feststoff, der primär als Reduktionsmittel Verwendung findet. Er gehört zur Klasse der Interkalationsverbindungen.
| Kristallstruktur | ||||||||
|---|---|---|---|---|---|---|---|---|
  | ||||||||
| _ K _ C | ||||||||
| Kristallsystem | ||||||||
| Raumgruppe |
Fddd (Nr. 70)[1] | |||||||
| Gitterparameter |
a = 492 pm c = 535 pm[2] | |||||||
| Allgemeines | ||||||||
| Name | KC8 | |||||||
| Andere Namen |
| |||||||
| Verhältnisformel | KC8 | |||||||
| Kurzbeschreibung |
bronzefarbener Feststoff[3] | |||||||
| Externe Identifikatoren/Datenbanken | ||||||||
| ||||||||
| Eigenschaften | ||||||||
| Molare Masse | 135,18 g·mol−1 | |||||||
| Aggregatzustand |
fest | |||||||
| Sicherheitshinweise | ||||||||
| ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||
Darstellung
Erstmals Dargestellt wurde KC8 von Karl Fredenhagen und Gustav Cadenbach im Jahr 1926.[5] Die Synthese erfolgt heutzutage durch Mischung stöchiometrischer Mengen von Kalium und Graphit. Erhitzen dieser Mischung führt zum Schmelzen des Kaliums und zum sofortigen Start der exothermen Reaktion. Es bildet sich innerhalb kurzer Zeit das Produkt in Form eines bronzefarbenen Feststoffs.[3][6]
Eigenschaften

KC8 ist eine hochreaktive Verbindung, die bei Luftkontakt Funken sprüht und daher unter Stickstoff- oder Edelgasatmosphäre gehandhabt werden muss.[3]
Außerdem besitzt dieses Kaliumgraphit eine Schichtstruktur, bei der die Kohlenstoffschichten einen Abstand von 5,35 Å aufweisen. Dieser ist deutlich größer als der Abstand der Kohlenstoffschichten im Graphit (3,35 Å) und auf die Platzierung der Kaliumatome zwischen den Schichten zurückzuführen. Die Kohlenstoffatome der Kohlenstoffschichten liegen übereinander, die Kaliumionen liegen zwischen den Graphitschichten. Dadurch ergibt sich die Schichtfolge C, K; C, K; .... Die Kaliumatome liegen wiederum über und unter den Mitten der Sechsecke, die der Kohlenstoff ausbildet.[7]
Die Verbindung besitzt außerdem metallisches Leitvermögen. In Schichtrichtung ist dieses etwa 30-mal und senkrecht dazu etwa zehnmal so hoch wie in den entsprechenden Richtungen in Graphit.[7]
Verwendung
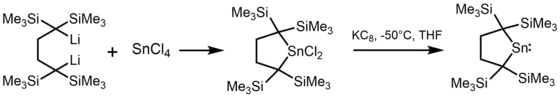
KC8 findet primär als starkes Reduktionsmittel Verwendung. So nutzten Mitsou Kira und seine Mitarbeiter die Verbindung zur Synthese von Stannylenen.[8]
Auf analoge Weise konnte Simon Aldridge et al. KC8 2018 nutzen, um ein Aluminiumiodid zum ersten nucleophilen Aluminiumanion zu reduzieren.[9]
Weiterhin kann KC8 als Katalysator zur Ethylenpolymerisation dienen.[3]
Außerdem wird KC8 wie viele andere Interkalationsverbindungen in der Batterieforschung untersucht.[10][11]
Siehe auch
Einzelnachweise
- D.P. Divincenzo, N.A.W. Holzwarth, S. Rabii: The electronic structure of KC8. In: Physica B+C. Band 99, Nr. 1-4, Januar 1980, S. 406–410, doi:10.1016/0378-4363(80)90268-5.
- M. C. Böhm, J. Schulte, R. Schlögl: Solid state electronic structure of potassium graphite intercalation compounds; the systems KC24 and KC8. In: physica status solidi (b). Band 196, Nr. 1, 1. Juli 1996, S. 131–144, doi:10.1002/pssb.2221960114.
- H. Podall, W. E. Foster, A. P. Giraitis: Catalytic Graphite Inclusion Compounds. I. Potassium Graphite as a Polymerization Catalyst. In: The Journal of Organic Chemistry. Band 23, Nr. 1, Januar 1958, S. 82–85, doi:10.1021/jo01095a025.
- Sicherheitsdatenblatt von KC8. bei Strem, abgerufen am 29. Januar 2020.
- Karl Fredenhagen, Gustav Cadenbach: Die Bindung von Kalium durch Kohlenstoff. In: Zeitschrift für anorganische und allgemeine Chemie. Band 158, Nr. 1, 23. November 1926, S. 249–263, doi:10.1002/zaac.19261580122.
- D. M. Ottmers, H. F. Rase: Potassium graphites prepared by mixed-reaction technique. In: Carbon. Band 4, Nr. 1, Mai 1966, ISSN 0008-6223, S. 125–127, doi:10.1016/0008-6223(66)90017-0.
- Wiberg, Egon, Wiberg, Nils: Holleman-Wiberg Lehrbuch der Anorganischen Chemie. 102., stark umgearbeitete und verb. Auflage. De Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Mitsuo Kira, Shintaro Ishida, Takeaki Iwamoto, Rika Yauchibara, Hideki Sakurai: New synthesis of a stable dialkylstannylene and its reversible complexation with tetrahydrofuran. In: Journal of Organometallic Chemistry. Band 636, Nr. 1–2, November 2001, S. 144–147, doi:10.1016/S0022-328X(01)00998-6.
- Jamie Hicks, Petra Vasko, Jose M. Goicoechea, Simon Aldridge: Synthesis, structure and reaction chemistry of a nucleophilic aluminyl anion. In: Nature. Band 557, Nr. 7703, Mai 2018, S. 92–95, doi:10.1038/s41586-018-0037-y.
- Jiantie Xu, Yuhai Dou, Zengxi Wei, Jianmin Ma, Yonghong Deng: Recent Progress in Graphite Intercalation Compounds for Rechargeable Metal (Li, Na, K, Al)-Ion Batteries. In: Advanced Science. Band 4, Nr. 10, Oktober 2017, S. 1700146, doi:10.1002/advs.201700146, PMID 29051856, PMC 5644242 (freier Volltext).
- R. Tossici: Electrochemistry of KC[sub 8] in Lithium-Containing Electrolytes and Its Use in Lithium-Ion Cells. In: Journal of The Electrochemical Society. Band 144, Nr. 1, 1997, S. 186, doi:10.1149/1.1837383.

