Hinterkiemerschnecken
Als Hinterkiemerschnecken (Opisthobranchia, griechisch οπισθοβράγχια – ὄπισθεν „hinter“, βράγχιον „Kieme“) wird die Gruppe der Schnecken bezeichnet, die hinter dem Herzen liegende Kiemen und meist eine seitlich liegende Mantelhöhle besitzen (allerdings fehlt diese Mantelhöhle der größten Unterordnung der Hinterkiemerschnecken, den Nacktkiemern). Hinterkiemer sind Zwitter und besitzen Zwitterdrüsen. Viele haben eine rückgebildete oder gar keine Schale und anstelle von Kammkiemen rückenseitige Federkiemen bzw. Hautatmung. Schalenlose Arten entwickelten Abschreckungs-, Tarn- oder Ablenktechniken zur Selbstverteidigung. Die meisten siedeln in Meeresbodennähe. Es gibt jedoch auch Dauerschwimmer und wenige Süßwasserarten. Hinterkiemer ernähren sich von Aas und Pflanzenresten, weiden Seepflanzenbestände, Kolonien von Kleintieren, Schwämmen, Nesseltieren ab, oder erjagen Beutetiere. Eine Besonderheit sind Arten mit indirekt genutzter Photosynthese durch unverdaute symbiotische Kleinalgen oder übernommene Chloroplasten. Ihr recht kurzes Leben läuft in zwei bis drei Entwicklungsphasen ab. Die nicht durchgängig vorhandene Larvenphase (Veligerlarven) wird oft als Plankton verbracht. Das Taxon ist schon seit dem 19. Jahrhundert bekannt und auch in den modernen Systematiken von Ponder & Lindberg (1997) bzw. von Bouchet & Rocroi (2005) ein fester Bestandteil.
| Hinterkiemerschnecken | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Verschiedene Hinterkiemer (Opisthobranchia) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Opisthobranchia | ||||||||||||
| H. Milne Edwards, 1848[1] |
Einige Merkmale
Das dominante Merkmal der Hinterkiemerschnecken (Opisthobranchia) sind rechts hinter dem Herzen liegende Kiemen.
Diese Lage ist ein Produkt der Schneckenontogenese. Diese beginnt mit einem Mantel (Pallium). An dessen einem Ende (Kopfende) befinden sich u. a. der Schlund, Augen, und Nervenganglien. Dem nachgelagert sind u. a. die inneren Organe. Der Verdauungstrakt von Schlund bis After und paarige Nervenstränge durchziehen den Körper vom Kopf bis zum Ende. Durch die Ausbildung des starken Fußmuskels an der Unterseite vom Kopf in Richtung Ende wird der weichere nachgelagerte Anteil mit den inneren Organen nach oben gedrückt und vollzieht dabei eine Rechtsdrehung (Torsion). Dabei bleibt die innere Reihenfolge der Organe im Mantelsack (Eingeweidesack) unverändert. Von außen betrachtet ändert sich jedoch die Position der Organe gemessen als Abstand vom Kopf gegenüber dem Zustand vor der Torsion. Bei den Vorderkiemern führte eine Torsion von 180° dazu, dass die Kiemen näher am Kopfende sind als das Herz. Bei den Hinterkiemern schließt sich jedoch eine Detorsionsphase an, in der die Lageveränderungen der ersten Torsion teilweise rückgängig gemacht wird. Danach befindet sich das Herz wieder näher am Kopf als die Kiemen und der Mantelsack schräg rechts hinter dem Herzen.
Auf dem Kopf tragen die meisten Hinterkiemerschnecken, insbesondere die Nacktkiemer, paarige Rhinophoren zur olfaktorischen Wahrnehmung und zur Rheorezeption (Strömungswahrnehmung). Es handelt sich um mehr oder weniger auffällige keulenförmige, stabförmige, fächerförmige oder schüsselförmige Ausstülpungen, welche viele zum Schutz einziehen können.[2][3][4]

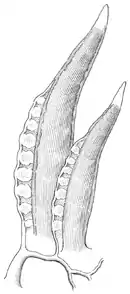
Atmung Die Atmung erfolgt bei vielen Arten durch die sich in der Mantelsackhöhle befindlichen Kammkiemen (Ctenidien). Kammkiemen sind mit vielen Haarzellen (Ciliarzellen) besetzte, gut durchblutete Hautausstülpungen, die bei gerichtetem Durchströmen von Wasser den Gasaustausch vornehmen. Bei den Nacktkiemern sind Mantelhöhle und Kiemen jedoch zurückgebildet. Stattdessen bilden sich auf dem Rücken (dorsal) Hautfortsätze (Cerata), die von feinen, mit dem Herzkreislauf verbundenen Kapillargefäßen durchzogen sind. Die Cerata verästeln sich intern oder extern sehr stark. In letzterem Falle bringen die Arten verschiedene charakteristische Formen hervor: Rosetten, vereinzelte Bündel, gestielte und ungestielte Büschel, u. a.m. Ähnlich wie bei den inneren Kiemen vergrößert das starke Verzweigen die Hautoberfläche und verbessert den Gasaustausch mit dem Wasser. Man spricht daher gerade bei starken externen Verzweigungen von Federkiemen.
Bei diversen Schnecken (z. B. Aeolidiidae) werden die Cerata von mit dem Verdauungstrakt verbundenen Papillaren durchlaufen und übernehmen u. a. Verteidigungsaufgaben, siehe Schutzmechanismen.

Die Hinterkiemerschnecken variieren in der Größe von wenigen Millimetern bis hin zu Dutzenden Zentimetern. Viele Schnecken haben eine Länge von etwa 2–6 cm. Winzige Schnecken findet man in verschiedenen Familien der Unterordnung der Kopfschildschnecken (Cephalaspidea), z. B. Noalda (0,9 mm), Retusa sp. (1,5 mm). Analog sehr kleine Schnecken wie z. B. Acteon lacunatus, Acteon parallelus, Acteon semicingulatus (3 mm), Enotepteron rosewateri (4 mm), Siphopteron quadrispinosum (5 mm). Kleinere Schnecken sind z. B. Hermaea dendritis (11 mm), Coryphella gracilis (15 mm). Schnecken mittlerer Größe sind z. B. Grüne Samtschnecke (oft 2 cm), Glaucus atlanticus (4 cm), Bulla striata (6 cm). Größere Schneckenarten sind die Zottige Bäumchenschnecke (10 cm), Tritona hombergi (12 cm). Mit die größten Schnecken stellt die Gattung Seehasen (Aplysia). Im europäischen Raum fand man Alypsia fasciata von 40 cm Länge. Von Aplysia vaccaria sind sogar 75 cm lange Exemplare bekannt.
Hinterkiemer haben folgende Lebensphasen: die Reifephase in der Eizelle in Gelegen oder Laichschnüren, die mit dem Schlüpfen abgeschlossen wird, die nicht bei allen Arten vorhandene Larvenphase, oft als Plankton verbracht, die mit der Metamorphose (Gestaltungsumwandlung) endet, und die Phase als eigentliche Schnecke mit Reproduktion. Die Lebenserwartung der Hinterkiemer ist nicht sehr hoch. Sie liegt bei vielen Arten bei in etwa einem Jahr. Einige Schnecken sterben kurz nach der Eiablage. Es folgen einige exemplarische Lebenserwartungen: Eubranchus pallidus – 8 Monate, Archidoris tuberculata – 12 Monate, Aeolidia papillosa – 16 Monate, Dendronotus frondosus – 24 Monate.
Lebensräume
Aufgrund der Kiemen sind Hinterkiemerschnecken Wasserbewohner. Unter ihnen gibt es einige Süßwasserarten (innerhalb der Acochlidiacea).[5][6] Die dominante Zahl der Arten sind jedoch Meeresbewohner.
Die maritimen Lebensräume können nach unterschiedlichen Kriterien beschrieben werden:
- in Küstenferne nach Tiefe
- küstennahe Gebiete anhand von Gezeiten (Dauerflutzone, untere und obere Gezeitenzone, Gezeitentümpel)
- nach Bodentypen (Sandböden, Sedimentböden, Schlamm- und Schlickböden, Hartböden, Felsböden)
- nach Bewuchs (Algen-, Tangwälder, Seegraswiesen, Korallenbänke, Kolonien von Moostierchen, Schwämmen, Nesseltieren)
- nach Klimazonen (arktische – tropische Meere)
Die Gruppe der Hinterkiemerschnecken umfasst ein sehr breites Artenspektrum. Es verwundert daher nicht, dass sie in allen Meeren und Ozeanen vorkommen und sich unterschiedlichste Lebensräume erschlossen haben.
Klimazonen. Hinterkiemer leben in alle Meeren und Ozeanen. Extrembewohner sind jedoch Arten, die in arktische Gewässern leben bzw. die Antarktis besiedeln. In arktischen Gewässern wurde z. B. die Zottige Bäumchenschnecke (Dendronotus frondosus) beobachtet. An den Küsten von Spitzbergen wurde Coryphella verrucosa nachgewiesen. In Küstengebieten der Antarktis[7] wurden Schnecken der Art Notaeolidia depressa gefunden.

Tiefe. Das Leben der Schnecken ist an ihre Nahrungsquellen gekoppelt. Insofern sind beispielsweise von Arten, die direkt oder indirekt von photosynthetisierenden Pflanzen leben, keine Tiefseerekorde unterhalb des Mesopelagial (unterhalb 1000 m) zu erwarten. Das Gros der Schnecken lebt in der Euphotischen Zone des Epipelagials, in der die Photosynthese stattfindet, der höchste Artenreichtum und die höchste Bioaktivität zu verzeichnen ist. Es gibt jedoch in der Tat einige Hinterkiemer, die sich an das Leben in Tiefseegebieten angepasst haben. Nachfolgend einige Beispiele. Arten, die in Gezeitentümpeln oder Flachwassergebieten leben, sind u. a. Aplysia punctata, Onchidoris muricata (bis 15 m), Goniodoris castanea (bis 25 m). Arten, die in der Dauerflutzone leben, sind u. a. Tritonia plebeia (bis 130 m). Arten, die unterhalb der unteren Gezeiten- bzw. Dauerflutzone zu leben, sind u. a. Archidoris tuberculata (bis 300 m), Coryphella verrucosa (bis 450 m), Breitwarzige Fadenschnecke (Aeolidia papillosa) (bis 800 m). Arten, die in der Tiefsee gefunden worden, sind u. a. Acteon hebes (800–4700 m), Acteon melampoides (400–4700 m).
Ein anderes Extrem in Hinsicht auf die Wassertiefe bilden Dauerschwimmer wie der hochseetüchtige Glaucus atlanticus. Aufgrund geschluckter Luftblasen schwimmt er in Rückenlage und von Meeresströmungen geleitet an der Wasseroberfläche.
Bodentypen. Schlamm- und Schlickböden befinden sich meist in der Nähe größerer Pflanzenkolonien, von Küsten, in Wattgebieten. Sie werden von Resteverwertern besiedelt, die daraus Nährstoffe gewinnen, aber auch von Beutejägern, die Kleintiere erjagen bzw. eingegrabene Tiere ausgraben. Hartböden sind Untergründe aus Steine, Bohlen, Metall. Sie können natürlich oder künstlich (Molen, Brücken, Schiffswände, Spundwände, versunkene Objekte etc.) entstanden sein. Schneckenbewohner von Hartböden sind u. a. Archidoris tuberculata oder Acanthodoris pilosa. Felsböden treten auf Meeresböden auf, häufig aber auch an rauen Küstenabschnitten. Sie werden z. B. von Arten der Furchenschnecken (Janolus cristatus) oder Fadenschnecken (Facelina coronata, Facelina bostoniensis) bewohnt.
Bodenbewuchs. Flächige Kolonien von Wasserpflanzen oder sessilen Wassertieren werden oft von Fadenschnecken bewohnt.
Fortpflanzung
Hinterkiemer sind Zwittertiere. Sie haben sogenannte Zwitterdrüsen, Keimdrüsen, die beide für die Fortpflanzung notwendigen Keimzellen erzeugen.
Übertragung von Samenzellen
Anders als die ebenfalls zwittrigen Echten Bandwürmer, sind die Hinterkiemer keine Selbstbefruchter, sondern benötigen für die Befruchtung der Eizellen einen Partner. Bei der Paarung nähern sich beide Partner dicht aneinander an, bringen ihre Geschlechtsöffnungen übereinander und vollziehen einen Samenaustausch. Dabei kann es sein, dass die Begattung wechselseitig stattfindet, also beide Partner als Männchen und als Weibchen fungieren. Es kommen auch, vor allem bei hoher Populationsdichte, sog. Paarungsketten vor (z. B. bei Seehasen), bei denen das hinterste Tier nur als Männchen, das vorderste Tier nur als Weibchen und die Tiere dazwischen als Männchen und als Weibchen fungieren.
Schneckeneier
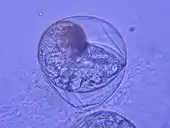
Als Ergebnis werden später Eizellen in gallertartigen, dem Schutz dienenden Hüllen in Gelegen oder gekräuselten, gedrehten Laichschnüren bzw. -bändern abgesondert. Die Hüllen unterscheiden sich in Konsistenz und Festigkeit, die Eizellen in Reichhaltigkeit. Bei einigen Arten sind den Eizellen Nährstoffen beigefügt, oder gibt es in den Hüllen Zellen, die als Nahrungsdepot in der Reifephase dienen. Die Gelege werden am Boden verankert oder an Steinen, Felsen befestigt. In Küstennähe werden sie an wellengeschützten Stellen abgelegt. Die Laichschnüre werden je nach Lebensraum am Boden, an Algen, Tang, Seegras, Polypenstöcken oder anderweitig befestigt.

Gelege und Laichschnüre werden nach der Ablage jedoch ohne weitere Brutpflege sich selbst überlassen. Die Zahl der abgesonderten Eizellen ist sehr unterschiedlich. Kopfschildschnecken der Art Retusa obtusa deponieren etwa 50 Eier in bis zu vier, der Art Retusa truncatula etwa 700 Eier in einem Bodengelege. Fadenschnecken der Art Facelina coronata legen bis zu 30.000 Eier, Meereszitronen der Art Archidoris tuberculata sogar bis zu 300.000 Eier in Laichschnüren ab.

Die Zahl der Eier und die Qualität der Gallerthüllen repräsentieren zwei fundamentale Entwicklungsprinzipien: Qualität versus Quantität. Während die Bodengelege durch Lage und festere Hüllen gut geschützt sind, die enthaltenen Eier reichhaltig und mit Nährstoffe für die angehenden Schnecken versorgt sind, stehen die Laichschnüre mit großer Stückzahl für Massenproduktion einfacher Eiern. Im Sinne des Ziels des Überlebens als Population kann jedoch keine der Strategien als eindeutiger Sieger gekürt werden. Wenige, gut geschützte und ausgestattete Eier genügen, da durch gute Vorsorge die Verlustquote pro Individuum gesenkt wurde. Allerdings ist der Bestand weniger katastrophenresistent. Bei vielen Eiern ist zwar die Verlustquote pro Individuum hoch. Auf der Ebene der Population wird das aber durch die große Anzahl der Individuen und die Möglichkeit des breiteren Streuens der Nachkommen kompensiert: für den Bestandserhalt genügt meist das Überleben weniger Exemplare. Insofern ist lokal die „bessere Wahl“ biotopabhängig.
Vom Ei zur Schnecke
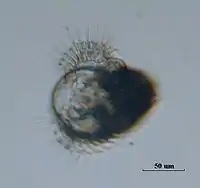
Aus den Eizellen schlüpfen später entweder voll entwickelte Jungschnecken (z. B. bei der Retusa obtusa) oder bei vielen Arten sogenannte Veligerlarven. Die Larven sind unterschiedlich weit entwickelt: einige (z. B. die Coryphella browni, Archidoris tuberculata) schlüpfen mit schutzgebenden kleinen Schalen. Auch Arten, die als erwachsene Schnecken Nacktschnecken sind, haben als Larve oft anfangs noch eine Schale (z. B. der Seeengel Clione limacina). Die Veligerlarven werden nach dem Schlüpfen durch die Wasserbewegung im Lebensraum (Bodenbereiche, Algen- und Tangwälder, Seegraswiesen) verteilt. Entweder sie verbleiben dort. Oder sie werden von Strömungen fortgetrieben, leben temporär als Plankton, bevor sie auf den Boden fallen; so erschließen die Schnecken sich u. U. sogar neue Lebensräume. Erst nach teils drastischen Gestaltsumwandlungen entstehen aus den Larven dann die Schnecken in ihrer Endform.
Zeitabläufe
Eine Samenübertragung geschieht bei diversen Arten nicht bei jedem Aufeinandertreffen, sondern zu ein bis zwei Paarungszeiten im Jahr. Die Eizellen werden nicht unbedingt sofort während oder nach der Samenübertragung befruchtet und ausgesetzt, sondern Spermien können zwischengelagert und die befruchteten Eizellen zeitlich versetzt abgesondert werden. Das Heranreifen von Jungschnecken bzw. Veligerlarven dauert artabhängig von einigen Tagen bis hin zu einigen Wochen. Bei der Kopfschildschnecke Retusa obtusa schlüpfen nach ca. vier Wochen voll ausgebildete Jungschnecken. Die Veligerlarven schlüpfen bei Retusa truncatula nach wenigen Tagen, bei Flabellina affinis nach fünf bis acht Tagen, bei Coryphella browni nach zwei Wochen, bei Janolus cristatus erst nach drei Wochen. Auch die Larven- bzw. Planktonphase ist artabhängig und kann sogar ein sehr großer Lebensabschnitt sein. Bei Aeolidia papillosa dauert die Planktonphase einige Wochen, bei der Archidoris tuberculata mehrere Monate (Lebenserwartung: rund zwölf Monate!). Flügelschnecken (Pteropoda) verbleiben sogar zeit ihres Lebens im Plankton.
Ernährung
Die Formen der Ernährung sind nicht spezifisch für die Hinterkiemer, sondern für die Biotope, in denen sie leben. Unter den Hinterkiemern gibt es daher Repräsentanten für jede Form sowie Mischformen.
Resteverwerter ernähren sich von Aas und Pflanzenresten. Man findet sie häufig in Arealen mit lockeren Böden, Schlamm-, Schlick-, Wattböden oder in Gebieten mit organischer Segmentation. Arten wie die Retusa obtusa durchwühlen die Böden.

Herbivore Schnecken (Pflanzenfresser) ernähren sich u. a. von Algen (von Böden, Steine, Pflanzen besiedelnden Kleinalgen bis hin zu Rot-, Braun- und Grünalgenwäldern), Tangwäldern, Seegraswiesen. Sie weiden die Pflanzenbestände z. T. systematisch ab. Beispiele für Pflanzenfresser sind die Seehasen (z. B. Aplysia punctata), die Gestreifte Meerblase (Bulla striata) und alle Schlundsackschnecken mit Ausnahme von drei Arten. Letztere haben sich darauf spezialisiert, Pflanzenzellen auszusaugen.
Carnivore Schnecken (Fleischfresser) gibt es in allen zugehörigen Ordnungen. Sie ernähren sich von anderen Tieren wie z. B. Moostierchen, Foraminiferen, Plattwürmern, Borstenwürmern, Schwämmen, Nesseltieren, Manteltieren, Muscheln, kleineren Schneckenarten, oder sogar von unterlegenen Exemplaren der eigenen Art. Unbewegliche Meerestiere wie Kolonien von Moostierchen, Nesseltieren, Felder von Schwämmen werden ähnlich wie die Pflanzen beweidet. Aufrechte Baumstrukturen werden meist Ast für Ast abgegrast. Bewegliche Beutetiere hingegen werden auf Wanderungen erjagt.
Das Fressen erfolgt, indem die Schnecken meist mit ihren Raspelzungen (Radula) Tierteile abgetragen. Einige Arten wie Retusa obtusa, Philine aperta oder Scaphander lignarius verschlingen die viel kleinere Beute als Ganzes und zerkleinern sie nachher in Mägen mit Kauplatten. Bei einigen dieser Arten sind daher Rückbildungen der Radula zu verzeichnen.

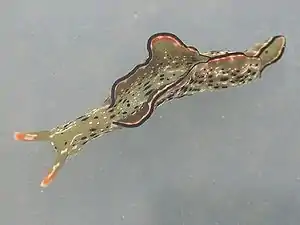
Ein interessantes Phänomen sind Schnecken, die indirekt die Photosynthese für die eigene Ernährung nutzen können. Dafür gibt es verschiedene Beispiele.
Die Schnecken der Gattung Phyllodesmium (Aeolidiidae) ernähren sich von Weichkorallen. Beim Fressen nehmen sie die mit diesen in Symbiose lebenden Zooxanthellen (symbiotische, einzellige Algen) ebenfalls auf. Die Algen werden nicht verdaut, sondern leben im Schneckendarm fort. Ihr Darm ist fast körperfüllend, reicht bis in die Körperfortsätze, und hat eine durchscheinende Außenhaut. Somit kann Licht zu den Zooxanthellen im Inneren gelangen und ermöglicht ihnen die Photosynthese. Das Phyllodesmium kann dann die durch die Algen erzeugten Kohlenhydrate verwerten und fast ohne Außennahrung auskommen.
Grüne Samtschnecken (Elysia viridis) oder Hermaea dentritica ernähren sich u. a. von Algen. Wenn sie den Inhalt der Algenzellen aufsaugen, nehmen sie auch pigmenthaltige Chloroplasten (Organelle) auf; das Chlorophyll gibt den Schnecken dann eine grüne Farbe, die auch der Tarnung dienen kann; die übernommenen Chloroplasten werden Kleptoplasten genannt. Die Organelle werden unzerstört über die verzweigten Mitteldarmdrüsen im Körper verteilt und schließlich unter der Außenhaut eingelagert. In der Schnecke bekommen die eingelagerten Organelle die Ausgangsstoffe für die Photosynthese: Licht durch die durchlässige Außenhülle, CO2 als Abprodukt des Zellstoffwechsels vom umgebenden Gewebe, sowie Wasser. Sie können daher weiter funktionieren und energiereiche Kohlenwasserstoffe herstellen, jedoch nicht auf Dauer: bei Elysia viridis mehrere Wochen, bei Hermaea dentritica nur einige Tage. Dann sterben die Organellen ab und müssen ersetzt werden. Bei Hermaea dentritica wirken die Fremdorganellen wie die Ersatzkomponente eines Hybridantriebs: mit ihnen überbrückt die Schnecke die Zeit bis zum Erschließen neuer Primärnahrung (Algen). Die Chloroplasten können in den Zellen der Schnecke nur überleben, weil ein sehr ungewöhnlicher horizontaler Gentransfer zwischen Pflanzenzelle und tierischer Zelle stattgefunden hat.
Schutzmechanismen
Hinterkiemer haben wie alle Wasserschnecken diverse potentielle Fressfeinde beginnend bei Artgenossen, größeren Schneckenarten bis hin zu Fischen. Das macht Schutzmechanismen erforderlich.
Bei Arten mit Gehäusen bilden die harten Gehäuse unterschiedlicher Auslegung quasi als ein mitgeführter Bunker einen natürlichen Schutz. Biologische Sensoren, die Vibrationen oder Wasserturbulenzen messen, auf Licht- bzw. Schattenveränderungen reagieren, bis hin zu Augen bilden das dazugehörige Frühwarnsystem.


Bei den hautatmenden Nacktkiemern funktioniert dieser Schutz jedoch in Ermangelung des Gehäuses nicht. Eine Möglichkeit besteht darin, den natürlichen Feinden durch den Einsatz von Giften oder ätzenden Stoffen die Lust am Verzehr zu nehmen. Alternativ werden Färbungen zur Abschreckung genutzt, dienen Färbungen, Oberflächenmuster und Formen zur Tarnung, werden Abwehr- oder Farbstoffe zu Verteidigungszwecken ausgestoßen.
Das verwendete Gift vieler Schnecken gelangt per Nahrungsaufnahme in deren Körper.
So ernähren sich etliche Nacktkiemer von Schwämmen, die hochgiftig und für andere Tiere ungenießbar sind. Die Schnecken können deren Gifte jedoch ohne Schaden aufnehmen und sammeln es in ihren Außenorganen.
Durch die Giftaufnahme überträgt sich die Schutzwirkung von der Beute auf die Schnecke. Gifte einlagernde Arten werden ungenießbar und als Beute unattraktiv. Beispiele sind einige Prachtschnecken (Chromodorididae) bzw. Warzenschnecken. Bei anderen Arten hat man durch Nahrungsversuche nachweisen können, dass sie Gift selber herstellen.

Eine ähnliche Methode praktizieren einige Fadenschnecken (Aeolidiidae). Sie ernähren sich gefahrlos von nesselbewehrten Korallen und Weichtieren. Über Mitteldarmfortsätze, die sich weit in die zahlreichen Rückenfortsätze hineinschieben, gelangen die Nesselkapseln (Nematocyten) der Beutetiere unversehrt an ihre Spitzen. Dort werden sie in körpereigenen Nesselsäcken deponiert und dienen fortan der Selbstverteidigung. Sie werden über Nesselkanäle abgeschossen oder beim Bruch der Cerataspitzen aktiviert. Da die Schnecken die Nesselkapseln nicht selbst herstellen, werden sie als Kleptocnide (Nesseldiebe) bezeichnet.
Des Weiteren gibt es eine Reihe von Nacktkiemern, die ätzende, saure Substanzen erzeugen. Die Phylliden, eine Gruppe innerhalb der Sternschnecken (Doridoidea), produzieren beispielsweise Alkylisocyanide, blausäurehaltige reaktive Verbindungen; Flankenkiemer (Notaspidea) oder die Offene Seemandel (Philine aperta) produzieren Schwefelsäure; weitere Beispiele sind Archidoris tuberculata und Polycera quadrilineata. Bei Berührung oder Bedrohung werden die ätzenden Stoffe in Hautsekreten verpackt von Drüsen nach außen hin abgesondert und verleiden so Angreifern die Lust an jeglichem Kontakt.
Giftige Seehasen (Aplysia gigantea)[8] und Flankenkiemerschnecken (Pleurobranchaea maculata) haben in Australien und Neuseeland den Tod zahlreicher Hunde verursacht, die am Strand an den Schnecken geleckt oder sie gefressen hatten. Pleurobranchaea produziert sogar Tetrodoxin, ein Nervengift, das man auch bei Kugelfischen und Blauringkraken findet.[9]
Wenn vorhanden, ist ein auffälliges äußeres Erscheinungsbild in grellbunten Farben ebenfalls nicht nur dekorativ, sondern sehr funktional.
Im Zusammenhang mit Körpergiften haben die Farben einen Signalcharakter. Sie sollen Angreifer warnen und abschrecken, damit es nicht zum Ernstfall des Gefressenwerdens kommt. Dem Schutz durch Abschreckung bedienen sich aber nicht nur gifte Arten, sondern auch einige ungiftige. Letztere weisen ebenfalls auffällige Farben auf, täuschen jedoch ihre Giftigkeit nur vor.
Alternativ werden Färbungen sowie Oberflächenmuster und Körperformen aber auch zur Tarnung verwendet. Zum Beispiel leben die an sich farblos-durchsichtigen Schlundsackschnecken der Art Hermea dentritica auf Grünalgen, saugen mit den Nährstoffen auch pigmenthaltige Chloroplasten aus ihnen heraus, nehmen dadurch die Farbe der Grünalgen an und sind somit perfekt getarnt. Die Violette Fadenschnecke (Flabelinae pedata) und die Violette Weißspitzenfadenschnecke (Coryphella pedata) haben zwar auf neutralem Hintergrund eine auffällige Form und Farbe. Doch ihr Lebensraum sind u. a. Rotalgenwälder. Darin sind sie farblich unauffällig, geben durch die vielen tentakelartigen Rückenfortsätze keine kompakte Fläche ab, und sind somit bei Unterwassersichtverhältnissen nur schwer auszumachen. Sternschnecken der Art Peltodoris atromaculata besitzen eine weiße Haut mit schwarzgeränderten dunkelbraunen Flecken verschiedener Größe. Auf den Schwämmen der Art Petrosia ficiformis lebend fallen sie durch die Färbung und leopardenartige Musterung aber nicht auf.
.jpg.webp)

Ein weiterer Schutzmechanismus ist ein Ablenkungsmanöver. Seehasen geben bei Berührung eine Tintenwolke ab. Einige Fadenschnecken ohne eingelagerte Nesselkapseln haben Cerata, die mit unangenehm riechenden Substanzen gefüllt sind (z. B. die Phyllodesmium magnum). Ähnlich wie Eidechsen ihre Schwänze, können sie bei Berührung einen oder mehrere Fortsätze abstoßen. Die abgestoßenen Fortsätze führen weiterhin Kontraktionen aus. Die stinkende Substanz tritt nach dem Abfall aus und wird verteilt. Das soll potentielle Angreifer irritieren und der Schnecke Zeit zur Flucht verschaffen.
Entwicklungsgeschichte
Man schätzt, dass es heute etwa 6.000 Arten gibt.
Systematik
Die Taxonomie der Schnecken unterliegt Revisionen und Wandel. Daher gibt es verschiedene Systematiken. Als klassisch wird meist die auf J. Thiele (1929–1935)[10] zurückgehende betrachtet. Sie war bis in die 1990er anerkannt. Eine modernere und die letzte aufgrund rein morphologischer Ansätze aufgestellte Systematik ist die von Ponder und Lindberg (1997).[11] Die aktuelle Systematik ist phylogenetisch orientiert und geht zurück auf Bouchet & Rocroi (2005).[12][13][14]
Taxonomie von Bouchet & Rocroi (2005)
Gemäß der Taxonomie von Bouchet & Rocroi (2005) sind die Opisthobranchia eine informelle Gruppe innerhalb des Clades der Verschieden-Kiemer (Heterobranchia):
- Klasse Gastropoda G. Cuvier, 1797
- Klade Heterobranchia J.E. Gray, 1840
- informelle Gruppe Niedere Heterobranchia
- informelle Gruppe Opisthobranchia H. Milne Edwards, 1848
- Klade Aplysiomorpha P.H. Fischer, 1883
- Klade Cephalaspidea P.H. Fischer, 1883
- Klade Gymnosomata H.M.D. de Blainville, 1824
- Klade Nudipleura H. Wägele & R.C. Willan, 2000
- Klade Sacoglossa H. von Ihering, 1876
- Klade Thecosomata H.M.D. de Blainville, 1824
- Klade Umbraculida W.H. Dall, 1889 (1827)
- Gruppe Acochlidiacea P. Bouchet & D.R. Lindberg, 2005
- Gruppe Cylindrobullida J. Thiele, 1931
- informelle Gruppe Pulmonata G. Cuvier in H.D.M. Blainville, 1814
- Klade Heterobranchia J.E. Gray, 1840
Gegenüber der Taxonomie von Ponder & Lindberg (1997) bestehen u. a. folgende Unterschiede:
- der Klade Cephalaspidea ist gegenüber der Unterordnung Cephalaspidea verkleinert,
- der Klade Nudipleura entstand aus der umstrukturierten Unterordnung Nudibranchia und einer Familie der Unterordnung Notaspidea,
- der Klade Umbraculida wurde neu gebildet und als Schwesterngruppe dem Klade Cephalaspidea zur Seite gestellt
- die Gruppe Acochlidiacea wurde hinzugefügt,
- die Gruppe Cylindrobullida wurde hinzugefügt, sie enthält eine Überfamilie Cylindrobulloidea, die bislang der Unterordnung Cephalaspidea zugeordnet war,
- die Unterordnung Notaspidea wurde aufgelöst; die Familien Tylodinidae und Umbraculidae wurden in der Überfamilie Umbraculoidea in dem Klade Umbraculida eingefügt; die Familie Pleurobranchidae wurde in der Überfamilie Pleurobranchoidea (Subklade Pleurobranchomorpha, Klade Nudipleura) eingefügt,
- beim Einfügen von Familien in neue Kladen wurden fehlende Untertaxa mit generiert.
Die Umgruppierungen sind das Ergebnis diverser phylogenetischer aber auch morphologischer Studien, die u. a.:
- die Paraphylie der Unterordnung Cephalaspidea
- die Paraphylie der Unterordnung Notaspidea[15],
- die Untercladen Nudibranchia und Pleurobranchomorpha bilden Schwesterngruppen
- die weitgehende Monophylie der Gruppe Acochlidiacea
zeigte.
Taxonomie von Ponder & Lindberg (1997)
Gemäß der Taxonomie von Ponder & Lindberg (1997) sind die Opisthobranchia eine Ordnung innerhalb der Überordnung der Verschieden-Kiemer (Heterobranchia):
- Klasse Gastropoda (Schnecken) G. Cuvier, 1797
- Unterklasse Orthogastropoda W.F. Ponder & D.R. Lindberg, 1995
- Teilklasse Apogastropoda L. Salvini-Plawen & G. Haszprunar, 1987
- Überordnung Heterobranchia J.E. Gray, 1840/G.Haszprunar, 1985[16]
- Ordnung Heterostropha (Verschieden-Dreher) P.H. Fischer, 1885
- Ordnung Opisthobranchia (Hinterkiemerschnecken) H. Milne Edwards, 1848
- Unterordnung Anaspidea (Seehasen) P.H. Fischer, 1883
- Unterordnung Cephalaspidea (Kopfschildschnecken) P.H. Fischer, 1883
- Unterordnung Gymnosomata (Ruderschnecken) H.M.D. de Blainville, 1824
- Unterordnung Notaspidea (Flankenkiemer) P.H. Fischer, 1883
- Unterordnung Nudibranchia (Nacktkiemer) H.M.D. de Blainville, 1814
- Unterordnung Sacoglossa (Schlundsackschnecken) H. von Ihering, 1876
- Unterordnung Thecosomata (Seeschmetterlinge) H.M.D. de Blainville, 1824
- Ordnung Pulmonata (Lungenschnecken) G. Cuvier in H.D.M. de Blainville, 1885
- Überordnung Heterobranchia J.E. Gray, 1840/G.Haszprunar, 1985[16]
- Teilklasse Apogastropoda L. Salvini-Plawen & G. Haszprunar, 1987
- Unterklasse Orthogastropoda W.F. Ponder & D.R. Lindberg, 1995
Die Änderungen gegenüber der vorangehenden Taxonomie gehen auf morphologische Studien zurück:
- das Problem der Paraphylie der Prosobranchia wurde gelöst
- teilweise Integration der Neubewertung der Beziehung zwischen Opisthobranchia und Pulmonata
Traditionelle Taxonomie
Ältere Taxonomien gehen auf J.Thiele zurück und verwenden basierend auf den Atemorganen eine Dreiteilung der Gastropoda. Die Opisthobranchia bilden einer der Hauptzweige.
- Gastropoda (Schnecken)
- Prosobranchia (Vorderkiemerschnecken)
- Archaeogastropoda (Altschnecken)
- Mesogastropoda (Mittelschnecken)
- Neogastropoda (Neuschnecken)
- Allogastropoda
- Opisthobranchia (Hinterkiemerschnecken)
- Cephalaspidea (Kopfschildschnecken)
- Acochlidiacea
- Sacoglossa (Schlundsackschnecken)
- Thecosomata (Seeschmetterlinge)
- Gymnosomata (Ruderschnecken)
- Anaspidea (Seehasen)
- Umbraculomorpha (Schirmschnecken)
- Pleurobranchmorpha (Seitenkiemer)
- Nudibranchia (Nacktkiemer)
- Doridoidei (Sternschnecken)
- Dendronotoidei (Bäumchenschnecken)
- Arminodei (Furchenschnecken)
- Aelidoidei (Fadenschnecken)
- Pulmonata (Lungenschnecken)
- Archaeopulmonata (Altlungenschnecken)
- Basommatophora (Wasserlungenschnecken)
- Stylommatophora (Landlungenschnecken)
- Prosobranchia (Vorderkiemerschnecken)
Siehe auch
Literatur
- Hans A. Baensch / Robert A. Patzner: Mergus Meerwasser-Atlas. Bände 2, 4 und 5, Mergus-Verlag, Melle.
- Svein A. Fosså, Alf Jacob Nilsen: Korallenriff-Aquarium. Band 5, Birgit Schmettkamp Verlag, Bornheim, ISBN 3-86659-014-8.
- Koralle. In: Meerwasseraquaristik-Fachmagazin. Nr. 26, April/Mai 2007, Natur und Tier Verlag Münster, ISSN 1439-779X.
- Helmut Debelius / Rudie H. Kuiter: Nacktschnecken der Weltmeere. Kosmos Verlag, ISBN 978-3-440-11133-8.
- Grell, K.-G. und IWF: Haminea hydatis (Opisthobranchia) - Embryonalentwicklung. Publikationen zu wissenschaftlichen Filmen, Serie 10, Nr. 47, 1977, IWF Göttingen, Sektion Biologie, ISSN 0073-8417, Begleitveröffentlichung zum Film des IWF, Göttingen.
- Kathe R. Jensen: Phylogenetic Systematics and Classification of the Sacoglossa (Mollusca, Gastropoda, Opisthobranchia). In: Philosophical Transactions: Biological Sciences. Band 351, Nr. 1335, S. 91–122, London 1996, ISSN 0080-4622.
- Heike Wägele und Annette Klussmann-Kolb: Opisthobranchia (Mollusca, Gastropoda) - more than just slimy slugs. Shell reduction and its implications on defence and foraging. In: Frontiers in zoology. Band 2, Nummer 1, Februar 2005, S. 3, doi:10.1186/1742-9994-2-3, PMID 15715915, PMC 554092 (freier Volltext).
- V. Vonnemann, M. Schroedl, A. Klussmann-Kolb und H. Wägele: Reconstruction of the phylogeny of the Opisthobranchia (Mollusca: Gastropoda) by means of 18S and 28S rRNA gene sequences. In: Journal of Molluscan Studies. Band 71, Nr. 2, S. 113–125, London 2005, ISSN 0260-1230, doi:10.1093/mollus/eyi014.
- Fredy Brauchli: Ein buntes Treiben. In: Online-Magazin Natürlich Leben. 03/2005, S. 26–31, PDF.
- Kathe R. Jensen: Sacoglossa (Mollusca:Gastropoda:Opisthobranchia) from Singapore. In: The Raffles Bulletin of Zoology. Supl.No.22, S. 207–223, 20. Dezember 2009, PDF.
- Seaslogforum: Phyllodesmium magnum, Abstoßen des Ceratas (Memento vom 13. März 2012 im Internet Archive), Zugang 11. Februar 2010.
Weblinks
- http://sn2000.taxonomy.nl Taxonomie
- http://www.marinespecies.org – Taxonomie, Literaturverweise
- http://www.seaslug.com – weiterführende Links: Taxonomie, Bilder etc.
- http://www.seaslugforum.net – Sea Slug Forum: Fachdiskussionen, Bilder
- http://slugsite.tierranet.com – weiterführende Links
- http://www.medslugs.de – Bildergalerie von Arten
- http://www.seaslugsofhawaii.com – Opisthobranchia: Bilder, Daten
- Robert Nordsieck: Hinterkiemerschnecken (Opisthobranchia) auf weichtiere.at.
Quellen
- H. Milne Edwards: Note sur la classifi¢cation naturelle des mollusques gaste¨ropodes. In: Annales des Sciences Naturelles. Paris (Serie 3), Band 9, 1848, S. 102–112.
- Volker Storch: Biogene Amine in Rezeptororganen von Gastropoden (Prosobranchia, Opisthobranchia). In: Zeitschrift für Zellforschung und mikroskopische Anatomie, Band 115, Nr. 1, 1971, S. 94–99.
- Volker Storch, Ulrich Welsch: Über Bau und Funktion der Nudibranchier-Rhinophoren. In: Zeitschrift für Zellforschung und mikroskopische Anatomie, Band 97, Nr. 4, 1969, S. 528–536.
- K. Göbbeler, A. Klussmann-Kolb: A comparative ultrastructural investigation of the cephalic sensory organs in Opisthobranchia (Mollusca, Gastropoda). In: Tissue and Cell, Band 39, Nr. 6, 2007, S. 399–414, doi:10.1016/j.tice.2007.07.002 (PDF).
- W. B. Rudman und R. C. Willan: Opisthobranchia. In: P. L. Beesley, G. J. B. Ross und A. Wells (Hrsg.): Mollusca: the southern synthesis. Fauna of Australia. 2. Bände, CSIRO, Melbourne 1998, ISBN 978-0-643-05756-2, S. 915–1035.
- C. Grande, J. Templado, J. Lucas Cercera und R. Zardoya: Molecular Phylogeny of Euthyneura (Mollusca: Gastropoda). In: Molecular Biology and Evolution. Band 21, Nr. 2, 2004, S. 303–313, doi:10.1093/molbev/msh016.
- Southern Ocean Mollusc Database (SOMBASE) (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- Bill Rudman: Aplysia gigantea auf seaslugforum.net.
- National Institute of Water and Atmospheric Research: Toxic Sea Slugs.
- Johannes Thiele: Handbuch der systematischen Weichtierkunde. 2 Bände. 1929–1935; englische Übersetzung: R. Bieler und P. M. Mikkelsen (wissenschaftliche Redaktion); J. S. Bhatti (Übersetzer): Handbook of systematic malacology. Publ: Washington, D.C.; Smithsonian Institution Libraries; National Science Foundation; 1992–. Teil 1: Loricata; Gastropoda: Prosobranchia; Teil 2: Gastropoda: Opisthobranchia and Pulmonata; Teil 3: Scaphopoda / Bivalvia / Cehalopoda; Teil 4: Comparative Morphology / Phylogeny / Geographical Distribution.
- Winston F. Ponder und David R. Lindberg: Towards a phylogeny of gastropod molluscs: an analysis using morphological characters. In: Zoological Journal of the Linnean Society. Band 119, Nr. 2, 1997, S. 83–265, doi:10.1111/j.1096-3642.1997.tb00137.x
- P. Bouchet und J.-P. Rocroi: Part 2. Working classification of the Gastropoda. In: Malacologia. Band 47, S. 239–283, Ann Arbor 2005, ISSN 0076-2997, archive.org, ConchBooks, ISBN 978-3-92591972-5.
- P. Bouchet und J.-P. Rocroi (Hrsg.): J. Frýda, B. Hausdorf, W. F. Ponder, Á. Valdés und A. Warén: Classification and nomenclator of gastropod families. In: Malacologia: International Journal of Malacology. Band 47, Nr. 1–2, ConchBooks, Hackenheim 2005, ISBN 3-925919-72-4, ISSN 0076-2997, http://www.vliz.be/Vmdcdata/imis2/ref.php?refid=78278
- G. T. Poppe und S. P. Tagaro: The New Classification of Gastropods according to Bouchet und Rocroi, 2005. 23. Februar 2006 PDF (Memento des Originals vom 27. September 2007 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- C. Grande, J. Templado, J. L. Cervera und R. Zardoya: Phylogenetic relationships among Opisthobranchia (Mollusca, Gastropoda) based on mitochondrial cox1, tmV, and rmL genes. In: Molecular Phylogenetics and Evolution. 33, 2004, S. 378–388. doi:10.1016/j.ympev.2004.06.008.
- G. Haszprunar: The Heterobranchia—a new concept of the phylogeny and evolution of the higher Gastropoda. In: Zeitschrift für Zoologische Systematik und Evolutionsforschung. Band 23, 1985, S. 15–37, doi:10.1111/j.1439-0469.1985.tb00567.x.