Rubidiumhydrogensulfat
Rubidiumhydrogensulfat ist ein Rubidiumsalz der Schwefelsäure.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
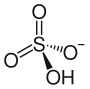 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Rubidiumhydrogensulfat | ||||||||||||
| Summenformel | RbHSO4 | ||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 182,54 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
2,89 g·cm−3[1] | ||||||||||||
| Schmelzpunkt |
207 °C[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Herstellung
Rubidiumhydrogensulfat kann durch Reaktion von stöchiometrischen Mengen von Rubidiumdisulfat und Wasser hergestellt werden.[4]
Analog zur Synthese von Kalium- und Natriumhydrogensulfat kann Rubidiumhydrogensulfat aus Rubidiumchlorid und mäßig warmer, konzentrierter Schwefelsäure hergestellt werden. Als Nebenprodukt entsteht Chlorwasserstoff.
Eigenschaften
Physikalische Eigenschaften
Rubidiumhydrogensulfat ist hygroskopisch.[4] Es kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2) mit den Gitterparametern a = 1440 pm, b = 462,2 pm, c = 1436 pm und β = 118,0°.[1] Die Kristalle sind isomorph zu den Kristallen von Ammoniumhydrogensulfat.[5]
Die Standardbildungsenthalpie von Rubidiumhydrogensulfat beträgt −1166 kJ/mol.[6] Die Lösungswärme beträgt −15,62 kJ/mol.[7]
Einzelnachweise
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 692 (eingeschränkte Vorschau in der Google-Buchsuche).
- N. Toupry, H. Poulet, M. Le Postellec (1981): Raman study of the phase transition in RbHSO4. In: Journal of Raman Spectroscopy, 11, 81-91. doi:10.1002/jrs.1250110207.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- S. B. Rasmussen, H. Hamma, K. M. Eriksen, G. Hatem, M. Gaune-Escard, R. Fehrmann: Physico-chemical properties and transition metal complex formation in alkali pyrosulfate and hydrogen sulfate melts. VII International Conference on Molten Slags Fluxes and Salts, The South African Institute of Mining and Metallurgy, 2004 (PDF; 661 kB).
- J. P. Ashmore, H. E. Petch: The Structure of RbHSO4 in its Paraelectric Phase. In: Can. J. Phys 1975, 53(24), S. 2694–2702. doi:10.1139/p75-328
- L. A. Cowan, R. M. Morcos, N. Hatada, A. Navrotsky, S. M. Haile: High temperature properties of Rb3H(SO4)2 at ambient pressure: Absence of a polymorphic, superprotonic transition. In: Solid State Ionics 2008, 179, S. 305–313 (PDF (Memento des Originals vom 22. Juni 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.; 837 kB).
- M. de Forcrand: "Sur les chlorures et sulfates de rubidium et de caesium" in Compt. Rend. Hebd. 1906, 143, S. 98 (Volltext).
- R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie. Verlag S. Hirzel, Bd. 2, 1908. S. 432 (Volltext).