Roflumilast
Roflumilast ist der erste zugelassene Arzneistoff aus der Gruppe der Phosphodiesterase-4-Hemmer (PDE-4-Hemmer), der zur Behandlung der chronisch obstruktiven Lungenerkrankung (COPD) eingesetzt wird.[2][3]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
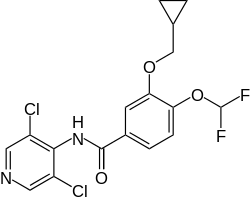 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Roflumilast | |||||||||||||||||||||
| Andere Namen |
N-(3,5-Dichlorpyrid-4-yl)-3-cyclopropylmethoxy-4-difluormethoxybenzamid (IUPAC) | |||||||||||||||||||||
| Summenformel | C17H14Cl2F2N2O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
R03DX07 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 403,21 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Klinische Angaben
Zugelassene Anwendungsgebiete
Roflumilast kann zur Dauertherapie bei erwachsenen Patienten mit schwerer COPD und chronischer Bronchitis sowie häufigen Verschlechterungen des Krankheitsbildes (sog. Exazerbationen) in der Vergangenheit zusätzlich zu einer Behandlung mit einem bronchodilatativen Arzneimittel eingesetzt werden. Eine schwere COPD im Sinne der Zulassung von Roflumilast weist eine verminderte Einsekundenkapazität (FEV1) nach Anwendung eines bronchodilatativen Arzneimittels von weniger als 50 % des Sollwerts auf.
Frühere klinische Studien zeigten, dass das therapeutische Fenster von PDE-4-Inhibitoren für die Anwendung bei Atemwegserkrankungen aufgrund von Dosis-limitierenden Nebenwirkungen wie Übelkeit, Diarrhoe und Kopfschmerz eingeschränkt ist.[4][5] Bei geringer Wirksamkeit des Wirkstoffes gegen COPD und Asthma zeigten diese Studien Nebenwirkungen im gastrointestinalen Bereich. Besonders bei untergewichtigen Patienten mit COPD ist eine mögliche weitere Gewichtsabnahme kritisch.[6] Die Kosten-Effektivität-Analyse kam zu dem Ergebnis, dass Roflumilast die Behandlungskosten für COPD erhöhen würde, dafür aber Folgekosten in der weiteren Behandlung der Patienten eingespart werden könnten.[7]
Weitere mögliche Anwendungsgebiete
Der Wirkstoff wurde auch zur Behandlung von Asthma bronchiale untersucht. Die Ergebnisse dieser Untersuchungen wurden jedoch bislang nicht veröffentlicht. Nach Angaben des Herstellers befand sich Roflumilast 2008 in der Entwicklungsphase I für die Anwendungsgebiete atopische Dermatitis und Schuppenflechte.[8]
Sonstige Angaben
Chemische und pharmazeutische Informationen
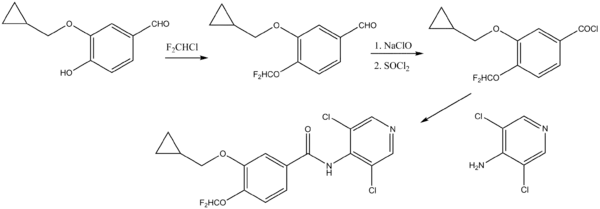
Der folgende Syntheseweg wurde in einem 1998 erteilten Patent beschrieben:[9]
Geschichtliches
Die 2006 von Nycomed übernommene Pharmasparte des Unternehmens Altana (ehemals Byk Gulden) hatte Roflumilast bereits 2004[10] in der EU zur Zulassung für COPD eingereicht, den Antrag aber 2005 nach Absprache mit der Europäischen Arzneimittelagentur wieder zurückgezogen.[11] Kurz zuvor hatte Altanas damaliger Entwicklungspartner Pfizer die Zusammenarbeit mit Altana beendet.[12]
2009 wurde der Zulassungsantrag aufgrund von positiven Ergebnissen in vier neuen klinischen Studien von Nycomed erneut in der EU eingereicht.[13] 2010 erteilte die Europäische Kommission dem Unternehmen Nycomed eine EU-Zulassung für Roflumilast.[2] 2011 erhielt der Hersteller auch eine Zulassung in den USA.[14] Eine Entscheidung für die Schweiz steht noch aus. Der Patentschutz für Roflumilast lief bereits im Jahr 2014 aus.[15]
Im Dezember 2015 gab AstraZeneca bekannt, dass es die weltweiten Vermarktungsrechte von Roflumilast übernehmen wird.[3]
Handelsnamen
- AstraZeneca: Daxas® (EU), Daliresp® (USA)
Literatur
- A. Hatzelmann, C. Schudt: Anti-inflammatory and Immunomodulatory Potential of the Novel PDE4 Inhibitor Roflumilast in vitro. Journal of Pharmacology and Experimental Therapeutics, 297, 267–279 (2001)
- B. M. Gensthaler: PDE-4-Hemmer gegen COPD und Asthma. Pharmazeutische Zeitung 14 (2003)
- S. A. Antoniu: New therapeutic options in the management of COPD – focus on roflumilast. In: International journal of chronic obstructive pulmonary disease. Band 6, 2011, S. 147–155, doi:10.2147/COPD.S7336. PMID 21468165. PMC 3064419 (freier Volltext).
Weblinks
- Einträge im NIH-Studienregister
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Roflumilast
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 3-(cyclopropylmethoxy)-N-(3,5-dichloropyridin-4-yl)-4-(difluoromethoxy)benzamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 12. Juli 2020.
- Zusammenfassung des Europäischen Öffentlichen Beurteilungsberichts (EPAR) für Daxas (PDF; 126 kB) Europäische Arzneimittelagentur. S. 3. Abgerufen am 16. Dezember 2015.
- AstraZeneca to strengthen therapy area franchise through acquisition of Takeda’s respiratory business, PM AstraZeneca vom 16. Dezember 2015, abgerufen am 16. Dezember 2015.
- Spina D. PDE4 inhibitors: current status. In: British Journal of Pharmacology, 2008, 155, S. 308-315, PMID 18660825.
- MA. Giembycz: Can the anti-inflammatory potential of PDE4 inhibitors be realized: guarded optimism or wishful thinking? In: British Journal of Pharmacology, 2008 155, S. 288-290, PMID 18660832.
- Roflumilast – ein neues Medikament bei COPD. (PDF; 98 kB) Sonderreport 7/2009, S. 11. Ars Medici. 2009; Band 99.
- SK. Field: Roflumilast: an oral, once-daily selective PDE-4 inhibitor for the management of COPD and asthma. In: Expert Opinion on Investigational Drugs. 2008 May, 17(5), S. 811-818, PMID 18447606.
- Forschungspipeline. (Memento vom 28. September 2008 im Internet Archive) Nycomed GmbH; abgerufen am 15. August 2008.
- Patent US5712298: Fluoroalkoxy-substituted benzamides and their use as cyclic nucleotide phosphodiesterase inhibitors. Veröffentlicht am 27. Januar 1998, Erfinder: Hermann Amschler.
- Altana AG: Presseerklärung vom 13. Februar 2004. Abgerufen am 15. August 2008.
- Altana AG: Presseerklärung vom 15. November 2005. Abgerufen am 15. August 2008.
- Altana AG: Presseerklärung vom 1. Juli 2005. Abgerufen am 15. August 2008.
- Nycomed beantragt europäische Marktzulassung für Daxas® zur Behandlung von COPD. Nycomed GmbH, Presseerklärung, 8. Mai 2009.
- FDA approves new drug to treat chronic obstructive pulmonary disease. U.S. Food and Drug Administration (1. März 2011); abgerufen am 20. Mai 2011.
- Nycomed’s Daxas takes an important step forward. Gerson Lehrman Group, 12. Mai 2009; abgerufen am 21. Juli 2009.