Rhinoviren
Als Rhinoviren (von altgriechisch ῥίς` rhis, deutsch ‚Nase‘, Genitiv ῥινός rhinos, deutsch ‚der Nase‘ und deutscher Plural von lateinisch vīrus) werden verschiedene Spezies (Arten) von Viren in der Gattung Enterovirus bezeichnet, die als Krankheitserreger hauptverantwortlich für Schnupfen und Erkältungen sind.[3][4] Diese Gattung Enterovirus der Rhinoviren gehört zur Familie Picornaviridae in der Ordnung Picornavirales (Name von pico, d. h. klein und RNA). Die Rhinoviren werden in der Taxonomie drei Spezies, Rhinovirus A–C (früher auch Humanes Rhinovirus A–C genannt).[5][6] Es wurden über 100 Serotypen beschrieben. Zu den genannten Vertretern kommt noch HRV-87, der nach NCBI ein Subtyp von Enterovirus D ist, daneben listet das NCBI noch etliche weitere nicht näher klassifizierte Rhinoviren.
| Rhinoviren | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
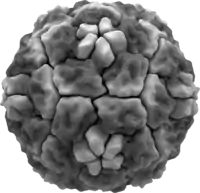
Darstellung Rhinovirus 14 | ||||||||||||||||||
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||
| ||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||
| Rhinovirus A, B, C, Enterovirus D | ||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||
| HRV-A, HRV-B, HRV-C; HRV-87 | ||||||||||||||||||
| Links | ||||||||||||||||||
|
Aufbau
Virion
Aufgrund der Homologie werden Rhinoviren in die genannten drei Gruppen (A bis C) unterteilt.[7] Rhinoviren sind unbehüllt, das heißt, sie besitzen keine Lipidschicht als Hülle. Ihr Durchmesser liegt zwischen 24 nm und 30 nm und damit gehören sie eher zu den kleinen Viren (150 S in einer Dichtegradientenzentrifugation). Sie sind im Vergleich zu den meisten übrigen Enteroviren relativ säureempfindlich und somit nicht Magensaft-resistent, jedoch thermostabiler, besitzen einen engeren Wirts-Tropismus und engere Replikationsbedingungen (nur niedrigere Temperaturen und nicht im Darmgewebe).[8] Jedes Kapsidprotein kommt 60-mal im ikosaedrischen Kapsid des Virions mit kubisch symmetrischem Aufbau vor. In der Mitte jeder der 20 Flächen des Kapsids ist eine Vertiefung (engl. canyon ‚Schlucht‘) zur Bindung des Rezeptors.[8] Das Kapsid hat eine Schichtdicke von etwa 5 nm. Etwa 90 % der Stämme der Spezies A und B verwenden ICAM-1 als zellulären Rezeptor, die restlichen 10 % verwenden den LDL-Rezeptor.[3] Die Stämme der Spezies C verwenden einen bisher unbekannten zellulären Rezeptor.
Genom
Rhinoviren sind RNA-Viren mit einzelsträngigem RNA-Genom positiver Polarität von etwa 7,2 bis 8,5 Kilobasen Länge. Die viralen Proteine werden als Polyprotein von etwa 2200 Aminosäuren hergestellt und anschließend durch zwei (durch die beiden pro-Gene 2Apro und 3Cpro codierten) Proteasen in die einzelnen Proteine gespalten.[9] Die im Virion befindlichen strukturellen Proteine werden im 5’-Bereich der RNA codiert, die nichtstrukturellen Proteine im 3’-Bereich (wie bei allen Picornaviren). Am 5’-Ende ist eine 5’ UTR, gefolgt von den Regionen P1 (Gene 1A-D für die vier Kapsidproteine VP1-4), P2 (Gene 2Apro, 2B, 2C), P3 (3A, 3B, 3Cpro, 3Dpol für das VPg, die Protease und die RNA-Polymerase), der 3’ UTR (redundant in einer Zellkultur) und einem Poly-A-Schwanz. Das 5’-Ende der viralen RNA ist mit dem viralen Protein VPg verbunden.
Proteine
Rhinoviren besitzen wie alle Picornaviren vier Kapsidproteine (VP1 bis VP4),[10][11] die neben der Verpackung des Genoms teilweise auch als Rezeptor für die Anheftung an eine Zelle dienen. Das VP4 verbindet die am Virion außenliegenden Proteine VP1, VP2 und VP3 mit dem Genom. VP1-3 werden als Oberflächenproteine verstärkt von Antikörpern erkannt. Nach einer Bindung des zellulären Rezeptors wird der N-Terminus des VP1 aus dem Virion nach außen gekehrt und das VP4 freigesetzt, welche gemeinsam eine Pore zur Penetration der Zellmembran bilden, durch die die virale RNA ins Zytosol geschleust wird.[12] Protein 2Apro ist eine Cysteinprotease zur Spaltung des Polyproteins zwischen der P1- und P2-Region.[12] Protein 2B dient der Destabilisierung der Zellmembran zur erleichterten Freisetzung neugebildeter Virionen aus der Zelle.[12] Protein 2C besitzt eine bisher unbekannte Funktion. Protein 3A ist ein Membranprotein zur Bindung der neugebildeten Virionen an die Zellmembran zur erleichterten Freisetzung. Protein 3B (syn. VPg, virales Protein am Genom) bindet an das 5’-Ende der viralen RNA und besitzt bisher unbekannte weitere Funktionen. Protein 3Cpro ist eine Cysteinprotease, die die zellulären Proteine Nup153, Nup214 und Nup358 spaltet und dadurch das Ausschleusen von Molekülen aus dem Zellkern unterbricht.[12] Protein 3DPol ist eine RNA-Polymerase zur Vervielfältigung der viralen RNA.[12] Die Proteine VP1-4 und VPg kommen im Virion vor und werden daher als strukturelle Proteine bezeichnet.
Replikationszyklus
Nach der Bindung an den jeweiligen Rezeptor erfolgt eine Penetration der Zellmembran durch die porenbildenden Proteine VP1 und VP4, wo aus der viralen RNA an den Ribosomen das virale Polyprotein hergestellt wird. Die Replikation der viralen RNA erfolgt nach einem Transfer ins glatte Endoplasmatische Retikulum (ER) durch die RNA-Polymerase 3DPol. Die kopierten Genome werden vom Endoplasmatischen Retikulum ins Zytosol geschleust, wo sich die virale RNA mit den viralen Proteinen zu Virionen zusammenfügen. Rhinoviren sind lytische Viren und verlassen die Wirtszelle durch Zerstörung ebendieser.
Vorkommen
Rhinoviren sind weltweit verbreitet und auf den Menschen begrenzt,[8] bevorzugen aber Temperaturen von 3 °C bis 33 °C, die sie auch unbedingt zu ihrer Vermehrung benötigen. Bei höheren Temperaturen – z. B. bei Körpertemperatur (36 °C bis 37,5 °C) – ist ihre Vermehrung hingegen gehemmt. Diese Vorliebe für etwas kühlere Temperaturen verursacht die höhere Infektionsrate bei nass-kaltem Wetter und den Tropismus für die kühlere Nasenschleimhaut. Da sich bei ausgekühlten Körpern die Blutgefäße in der Nasenschleimhaut zusammenziehen, sinkt die Temperatur der Nasenschleimhaut in den Bereich, der für diese Viren optimal ist.
Infektion
Infektionswege
Eher selten findet die Infektion durch die Übertragung von Viren in Tröpfchen verschiedener Körperflüssigkeiten, die beim Niesen oder Husten von bereits infizierten Menschen ausgeschleudert werden und dann über Tröpfcheninfektion auf einen anderen Menschen übertragen werden, statt, da die Rhinoviren in trockener Luft durch Trocknung in wenigen Minuten inaktiviert werden. In 80 % feuchter, 20 °C warmer Luft bleiben sie zwar stundenlang aktiv (Halbwertzeit 14 h);[13] da die größeren Tröpfchen aber schnell zu Boden sinken, nimmt die Virenkonzentration in der Luft nach einem Niesen dennoch schnell ab. Weitaus häufiger ist die direkte Übertragung, z. B. über kontaminierte Hände, oder die indirekte über Gegenstände (Schmierinfektion). Infiziert werden besonders oft Menschen, deren Abwehrkräfte geschwächt oder – wie bei Babys und Kleinkindern – noch nicht gegen die über 100 verschiedenen Rhinoviren ausgebildet sind.
Inkubationszeit
Die Inkubationszeit ist relativ kurz. Nach ein bis vier Tagen sind Viren in der Nase nachweisbar, danach werden zwei bis drei Tage Viren produziert, bis die adaptive Immunantwort eingreift.[8] Nach etwa 12 Stunden verlassen die ersten fertigen Viren die Wirtszelle und infizieren die nächste.
Infektionssymptome
Rhinoviren infizieren die Schleimhäute des Nasen- und Rachenraums, bleiben streng lokalisiert und verursachen keine generalisierte Infektion.[3] Es entsteht ein Schnupfen – seltener bei Kindern eine Bronchitis. Der menschliche Körper reagiert auf die Virenattacken mit einer Entzündungsreaktion der Nasenschleimhaut. Die Gefäße der Schleimhaut werden durchlässiger, Flüssigkeit tritt aus, die Nase läuft. Später schwillt die Nasenschleimhaut an, auf bis zu einem halben Zentimeter Dicke, wodurch das Atmen durch die Nase so gut wie unmöglich wird. Hinzu kommen eventuell Unwohlsein und Kopfschmerzen. Häufig tritt neben der viralen Infektion noch eine Sekundärinfektion durch Bakterien im Hals und Rachenraum auf.
Therapie und Prävention
Eine spezifische antivirale Therapie ist nicht verfügbar, ebenso wenig eine Immunprophylaxe (Impfung). Bei immunkompetenten Personen ist eine solche auch nicht erforderlich, da weder bleibende Schäden noch schwere Verläufe beobachtet werden. Die Therapie der Erkrankung beschränkt sich auf die Behandlung der Symptome, bis das Virus durch das Immunsystem wieder eliminiert und die Entzündungssymptome abgeklungen sind.
In den 1960er Jahren wurden verschiedene Impfstoffe hergestellt, die jedoch nur einen stammspezifischen Impfschutz erzeugen konnten. Auch eine Rhinovirus-Infektion führt zur Ausbildung von neutralisierenden Antikörpern, die jedoch nur eine stammspezifische Immunität hervorbringt. Rhinoviren neigen als RNA-Viren im Zuge der Immunevasion zur verstärkten Mutation und die Kapsidproteine von vier typischen Stämmen der Rhinoviren sind nur zwischen 41 und 83 % zueinander identisch, was die Bildung einer stammübergreifenden Immunität erschwert.[8] Bei Menschen, die bereits mehrere Infektionen verschiedener Stämme hatten, ist die Erkrankungsdauer etwas verkürzt.[8]
Prävention ist durch Expositionsprophylaxe (z. B. Händewaschen und Meiden von Menschenansammlungen) möglich, da man aufgrund der großen Anzahl von Serotypen und der nur typenspezifischen Immunität keine langfristig wirksamen Medikamente oder Impfstoffe herstellen kann. Daneben verhindert das Virostatikum Pleconaril das Entpacken des viralen Genoms nicht-resistenter Rhinoviren.[14]
Umweltstabilität
Rhinoviren haben als Picornaviren im Vergleich zu anderen Viren eine relativ hohe Tenazität, jedoch sind sie im Gegensatz zu den verwandten Enteroviren säureempfindlich. Die Tenazität der Rhinoviren umfasst aufgrund der fehlenden Virushülle eine relativ hohe Resistenz gegenüber Alkoholen (z. B. Ethanol, Isopropanol) und Tensiden,[15] sie können jedoch durch Händewaschen größtenteils von den Händen entfernt werden.[15] Rhinoviren sind empfindlich gegenüber Säuren,[16][17] Alkylanzien[18] und physikalischen Desinfektionsmethoden.
Einzelnachweise
- ICTV Master Species List 2018b.v2. MSL #34, März 2019
- ICTV: ICTV Taxonomy history: Enterovirus C, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- J. L. Kennedy, R. B. Turner, T. Braciale, P. W. Heymann, L. Borish: Pathogenesis of rhinovirus infection. In: Current opinion in virology. Band 2, Nummer 3, Juni 2012, ISSN 1879-6265, S. 287–293, doi:10.1016/j.coviro.2012.03.008, PMID 22542099. PMC 3378761 (freier Volltext).
- S. E. Jacobs, D. M. Lamson, K. St. George, T. J. Walsh: Human Rhinoviruses. In: Clinical Microbiology Reviews. Band 26, Nummer 1, Januar 2013, ISSN 0893-8512, S. 135–162, doi:10.1128/CMR.00077-12, PMID 23297263, PMC 3553670 (freier Volltext).
- ICTV: Master Species List 2018a v1, MSL including all taxa updates since the 2017 release. Fall 2018 (MSL #33)
- ViralZone: ICTV 2016 Master Species List #31 with Acronyms, (Excel XLSX), SIB Swiss Institute of Bioinformatics
- Y. A. Bochkov, A. C. Palmenberg, W. M. Lee, J. A. Rathe, S. P. Amineva, X. Sun, T. R. Pasic, N. N. Jarjour, S. B. Liggett, J. E. Gern: Molecular modeling, organ culture and reverse genetics for a newly identified human rhinovirus C. In: Nature Medicine. Band 17, Nummer 5, Mai 2011, ISSN 1546-170X, S. 627–632, doi:10.1038/nm.2358, PMID 21483405, PMC 3089712 (freier Volltext).
- D. M. Knipe, Peter M. Howley, D. E. Griffin, (Hrsg.): Fields Virology. (zwei Bände) 5. Auflage, Lippincott Williams & Wilkins, Philadelphia 2007, ISBN 978-0-7817-6060-7.
- Robert B Couch: Rhinoviruses:Replication. In: Anne O’Daly (Hrsg.): Encyclopedia of Life Sciences. John Wiley, 2005, ISBN 0-470-01590-X.
- M. Rossmann, E. Arnold, J. Erickson, E. Frankenberger, J. Griffith, H. Hecht, J. Johnson, G. Kamer, M. Luo, A. Mosser: Structure of a human common cold virus and functional relationship to other picornaviruses. In: Nature. 317, Nr. 6033, 1985, S. 145–153. bibcode:1985Natur.317..145R. doi:10.1038/317145a0. PMID 2993920.
- T. Smith, M. Kremer, M. Luo, G. Vriend, E. Arnold, G. Kamer, M. Rossmann, M. McKinlay, G. Diana, M. Otto: The site of attachment in Human rhinovirus 14 for antiviral agents that inhibit uncoating. In: Science. 233, Nr. 4770, 1986, S. 1286–1293. bibcode:1986Sci...233.1286S. doi:10.1126/science.3018924. PMID 3018924.
- Uniprot P03303.
- Y. G. Karim, M. K. Ijaz, S. A. Sattar, C. M. Johnson-Lussenburg: Effect of relative humidity on the airborne survival of rhinovirus-14. In: Canadian journal of microbiology. Band 31, Nummer 11, November 1985, ISSN 0008-4166, S. 1058–1061, PMID 3004682.
- M. Schmidtke, P. Wutzler, R. Zieger, O. B. Riabova, V. A. Makarov: New pleconaril and [(biphenyloxy)propyl]isoxazole derivatives with substitutions in the central ring exhibit antiviral activity against pleconaril-resistant coxsackievirus B3. In: Antiviral Research. Band 81, Nummer 1, Januar 2009, ISSN 1872-9096, S. 56–63, doi:10.1016/j.antiviral.2008.09.002, PMID 18840470.
- C. Savolainen-Kopra, T. Korpela, M. L. Simonen-Tikka, A. Amiryousefi, T. Ziegler, M. Roivainen, T. Hovi: Single treatment with ethanol hand rub is ineffective against human rhinovirus–hand washing with soap and water removes the virus efficiently. In: Journal of medical virology. Band 84, Nummer 3, März 2012, ISSN 1096-9071, S. 543–547, doi:10.1002/jmv.23222. PMID 22246844.
- R. B. Turner, K. A. Biedermann, J. M. Morgan, B. Keswick, K. D. Ertel, M. F. Barker: Efficacy of organic acids in hand cleansers for prevention of rhinovirus infections. In: Antimicrobial Agents and Chemotherapy. Band 48, Nummer 7, Juli 2004, ISSN 0066-4804, S. 2595–2598, doi:10.1128/AAC.48.7.2595-2598.2004, PMID 15215114, PMC 434190 (freier Volltext).
- R. B. Turner, J. O. Hendley: Virucidal hand treatments for prevention of rhinovirus infection. In: Journal of Antimicrobial Chemotherapy. Band 56, Nummer 5, November 2005, ISSN 0305-7453, S. 805–807, doi:10.1093/jac/dki329, PMID 16159927.
- K. Broo, J. Wei, D. Marshall, F. Brown, T. J. Smith, J. E. Johnson, A. Schneemann, G. Siuzdak: Viral capsid mobility: a dynamic conduit for inactivation. In: Proceedings of the National Academy of Sciences of the United States of America. Band 98, Nummer 5, Februar 2001, ISSN 0027-8424, S. 2274–2277, doi:10.1073/pnas.051598298, PMID 11226229, PMC 30128 (freier Volltext).
Literatur
- Samantha E. Jacobs, Daryl M. Lamson, Kirsten St. George, Thomas J. Walsh: Human Rhinoviruses. In: Clinical Microbiology Reviews. Band 26, Nummer 1, Januar 2013, ISSN 0893-8512, S. 135–162, doi:10.1128/CMR.00077-12, PMID 23297263, PMC 3553670 (freier Volltext).
- Ian M. Mackay, Katherine E. Arden: Rhinoviruses. In: Richard A. Kaslow, Lawrence R. Stanberry, James W. Le Duc (Hrsg.): Viral Infections of Humans. 5. Auflage. Springer, New York 2014, ISBN 978-1-4899-7447-1, S. 675–712.
- Ronald B. Turner: Rhinovirus. In: John E. Bennett, Raphael Dolin, Martin J. Blaser (Hrsg.): Principles and Practice of Infectious Diseases. Vol. 2, 8. Auflage. Elsevier Saunders, Philadelphia 2015, ISBN 9780443068393, S. 2113–2121.