Rasterionenleitfähigkeitsmikroskopie
Ein Rasterionenleitfähigkeitsmikroskop (englisch scanning ion conductance microscope, SICM) ist ein Mikroskop, das elektrisch nicht-leitende Proben mit Hilfe eines Ionenstroms abbildet.
Das Rasterionenleitfähigkeitsmikroskop wurde 1989 von P. K. Hansma, B. Drake, O. Marti, S. A. Gould und C. B. Prater entwickelt.[1]
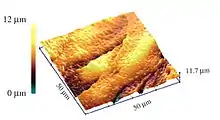
Messprinzip
Als Messgröße in der Rasterionenleitfähigkeitsmikroskopie dient die Ionenleitfähigkeit des Bereichs nahe der Öffnung einer mit Elektrolytlösung gefüllten Glasmikro- oder -nanokapillare – der Sonde – die in eine Elektrolytlösung eintaucht, in der sich die Probe befindet. Durch Anlegen einer Spannung zwischen zwei Metallelektroden, von denen sich eine in der Sonde und die andere in der Badlösung befindet, fließt ein Ionenstrom durch die Öffnung der Sonde. Die Leitfähigkeit des SICMs kann durch die Summe mehrerer Einzelleitfähigkeiten angenähert werden. Ist der Abstand zwischen Sondenöffnung und Probe groß (im Bereich mehrerer Öffnungsdurchmesser der Sonde), wird die Leitfähigkeit (bzw. ihr reziproker Wert, der Widerstand) von der Leitfähigkeit über die Sondenspitze und die Sondenöffnung dominiert. Bei Abständen zwischen Sonde und Probe im Bereich des Öffnungsdurchmessers der Sonde kommt es dazu, dass im Bereich direkt vor der Sondenöffnung die isolierende Probenoberfläche den Ionenstrom beeinflusst und die Leitfähigkeit in diesem Bereich verringert. Diese sogenannte Leck-Leitfähigkeit ist abhängig vom Abstand zwischen Sonde und Probe und außerdem deutlich geringer als die anderen Leitfähigkeiten, so dass eine Bestimmung der Gesamtleitfähigkeit des Systems eine gute Näherung für die der Leck-Leitfähigkeit darstellt, die genutzt wird, um den Abstand zwischen Probe und Sonde zu bestimmen.
Mathematische Beschreibung
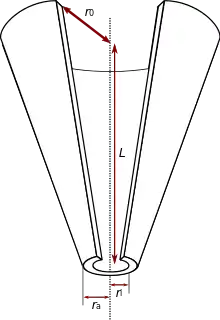
Üblicherweise kommen in der SICM ausgezogene Glaskapillaren als Sonde zum Einsatz, die als konisch zulaufende Hohlspitzen angenähert werden können. Basierend auf Analysen des Raster-Elektrochemiemikroskops[3] kann der Widerstand der Sonde als
angenähert werden[4], wobei die spezifische Leitfähigkeit des verwendeten Elektrolyten bezeichnet, die Länge des spitz zulaufenden Bereichs und und den Öffnungsradius des oberen und unteren Endes der Kapillare, vergleiche auch die Abbildung rechts. Der abstandsabhängige Leckwiderstand kann in einfacher Näherung als
betrachtet werden.[4] bezeichnet hier den Abstand zwischen Sondenöffnung und Oberfläche.
Der Ionenstrom im SICM kann als Summenstrom über diese beiden Widerstände angesehen und über das ohmsche Gesetz angenähert werden:
Da die Leitfähigkeit eines SICMs durch Strom- oder Widerstandsmessung bestimmt werden kann (siehe Bestimmung der Leitfähigkeit), wird im Weiteren der Widerstand betrachtet, der über das ohmsche Gesetz mit Strom und Spannung verknüpft ist und daher beide Methoden beschreibt.
Der abstandsabhängige Widerstand des SICMs ist demnach:
Für die meisten bildgebenden Untersuchungen ist die Kenntnis des absoluten Werts des Widerstandwerts nicht notwendig, interessant ist das Verhältnis des Widerstands im Vergleich zum Widerstand des Systems bei großem Abstand zwischen Sonde und Probe. Da für große Abstände gegen null geht, ergibt sich für den Widerstand bei „unendlichem“ Abstand zwischen Probe und Sonde:
Setzt man den aktuellen Widerstand ins Verhältnis zu , bildet also den normierten Widerstand , vereinfacht sich die Beschreibung des Widerstands im SICM zu
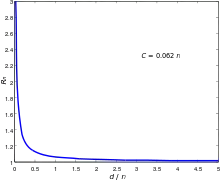
Da sich die geometrischen Parameter der Messsonde während einer Messung nicht ändern, kann man diese in einer Gerätekonstante zusammenfassen, so dass
erhalten wird. Da üblicherweise die zu Glaskapillaren ausgezogenen Gläser laut Herstellerangaben ein konstantes Verhältnis von Innen- zu Außendurchmesser aufweisen, fließt, bei gleicher Länge , der Öffnungsradius der Sonde linear in den Parameter ein.
Obige Gleichung beschreibt eine asymptotische Annäherung von (für ) gegen unendlich (für ), bei der die Krümmung der Asymptote durch den Parameter gegeben ist.
Oben beschriebene Zusammenhänge stellen lediglich Annäherungen aufgrund geometrischer Überlegungen dar. Aktuelle Untersuchungen nähern sich der Beschreibung des SICMs über Finite-Elemente-Simulationen[5]. Es zeigt sich, dass oben beschriebene Zusammenhänge nur für vereinfachte Probengeometrien zutreffen.[6][7]
Bestimmung der Leitfähigkeit
Gemäß dem ohmschen Gesetz berechnet sich die Leitfähigkeit als Quotient angelegter Spannung und dem gemessenen Strom. Daraus ergeben sich zwei Möglichkeiten, die Leitfähigkeit eines SICMs in Abhängigkeit vom Abstand zwischen Probe und Sonde zu bestimmen:
- Unter Verwendung einer konstanten Spannung wird der Strom gemessen, der fließt. Die in diesem Fall vorliegende Verwendung des Stroms als Messsignal bei konstanter Spannung ist aus der Elektrochemie als Amperometrie bekannt, in der Elektrophysiologie ist die Bezeichnung Spannungsklemme gebräuchlich (englisch: voltage clamp).
- Alternativ kann die an den verwendeten Metallelektroden anliegende Spannung so moduliert werden, dass ein konstanter Strom fließt. In diesem Fall ist die Spannung und nicht der Strom die Messgröße. Dieses Messverfahren ist in der Elektrochemie als Voltammetrie bekannt, in der Elektrophysiologie spricht man von Stromklemme (englisch current clamp).
Elimination langsamer Potentialveränderungen
Als Metallelektroden werden in SICMs häufig Silber-Silberchlorid-Elektroden (Ag/AgCl-Elektroden) verwendet, als Elektrolytlösungen werden, insbesondere um lebende Zellen abzubilden, physiologische Salzlösungen benutzt. Im Allgemeinen werden die Potentiale an den Grenzflächen von Ag/AgCl-Elektrode und Elektrolyt als konstant angenommen. In der Praxis ändern sich diese Potentiale jedoch langsam, was Änderungen in der Leitfähigkeit des SICMs zur Folge hat, die wiederum die Bestimmung der Leck-Leitfähigkeit beeinträchtigen. Um SICM-Messungen unabhängig von langsamen Potentialveränderungen durchzuführen, wurden Strom- bzw. Spannungspulse konstanter Größe anstelle eines konstanten Stroms bzw. einer konstanten Spannung appliziert[8]. Die Höhe des resultierenden Spannungs- bzw. Strompulses ist unabhängig von Potentialänderungen an den Metallelektroden und dient als Messgröße. Eine weitere Methode, Beeinträchtigungen durch Potentialdrift an den Metallelektroden zu minimieren ist die wiederholte Bestimmung der Leitfähigkeit des SICMs bei großem Abstand zwischen Probe und Sonde während einer Messung[9]. Hierdurch wird bei der Bestimmung der Leckleitfähigkeit die veränderte Basisleitfähigkeit berücksichtigt, so dass die fehlerhafte Detektion von Leitfähigkeitsänderungen aufgrund von langsamen Potentialänderungen anstelle von Änderungen des Abstands zwischen Probe und Sonde vermieden wird.
Aufbau
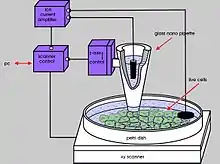
Ein SICM besteht aus der Messsonde sowie einem zugehörigen Messverstärker, der einen hohen Eingangswiderstand aufweisen muss, um den Stromfluss über den Widerstand der Messsonde, üblicherweise von wenigen bis zu einigen hundert Megaohm, messen zu können. Je nach Art der Leitfähigkeitsbestimmung kommt entweder ein Potentiostat (voltage clamp) oder ein Galvanostat (current clamp) zum Einsatz.
Die Sonde und die Probe sind so angebracht, dass sie relativ zueinander in alle drei Raumrichtungen zu bewegen sind, was durch piezoelektrische Aktoren erreicht wird. Es sind sowohl SICMs beschrieben, bei denen die Sonde[8][10] oder die Probe[11] in alle drei Raumrichtungen beweglich ist als auch solche, bei denen die Sonde vertikal und die Probe lateral bewegt werden kann.[12]
Um eine manuelle Vorpositionierung und -auswahl der Probe zu ermöglichen, sind SICMs üblicherweise auf inversen Lichtmikroskopen aufgebaut. Der Aufbau ähnelt somit dem eines elektrophysiologischen Messstands, wie er bspw. für Patch-Clamp-Messungen verwendet wird.
Messmodi
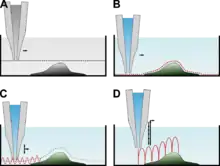
Seit der Entwicklung des ersten SICMs wurde die Methodik durch weitere Mess- oder Betriebsmodi verbessert. Im Gegensatz zur oben erläuterten Elimination langsamer Potentialdrifts unterscheiden sich die im Folgenden erläuterten Betriebsmodi darin, wie die Sonde über die Probe geführt wird.
Abscannen in konstanter Höhe
In diesem Modus wird die Messsonde bei einer konstanten vertikalen Position über die Probe bewegt. Der Abstand zwischen Sonde und Probe wird dabei durch die ermittelte Leitfähigkeit bestimmt. Wie in der Abbildung des normierten Widerstand gegen den Abstand von Sonde und Probe ersichtlich wird, ist eine Veränderung der Leitfähigkeit nur im Bereich einiger weniger Sondendurchmesser zu registrieren, der zusätzlich durch das Messrauschen eingeschränkt wird. Aus diesem Grund können mit diesem Messmodus nur Proben untersucht werden, deren Oberfläche nur geringe Höhenunterschiede aufweist. Größere Höhenunterschiede können entweder nicht detektiert werden (wenn der Abstand zwischen Sonde und Probe zu groß wird) oder aber führen dazu, dass die Sonde seitlich in die Probe fährt (wenn die Probe höher ist als die vertikale Position der Sonde).
Direct-Current-Modus (DC-Modus)
Im Direct-Current-Modus (DC-Modus) wird die Sonde zuerst soweit an die Probe angenähert, bis eine vorgegebene Widerstandsänderung erreicht wird. Daraufhin wird die Sonde seitlich über die Probe bewegt, wobei der Widerstand des Systems direkt als Rückkopplungssignal verwendet wird, um die vertikale Sondenposition zu verändern. Die Sonde fährt die Probe also in konstantem Abstand ab (weshalb dieser Modus auch engl. constant-distance mode genannt wird).
Alternating-Current-Modus (AC-Modus)
Dieser Modus ähnelt dem DC-Modus. Zusätzlich wird in diesem Modus die Position der Probenspitze um einige Nanometer und mit einigen Kilohertz moduliert, wodurch bei einem ausreichend geringen Abstand zwischen Probe und Sondenspitze ein ebenfalls sinusförmiges Messsignal entsteht. Als Rückkopplungssignal dient in diesem Modus die Amplitude des Messsignals. Die Amplitudenänderung ist im Vergleich zur direkten Änderung des Stroms im DC-Modus steiler, so dass die Probe in größerem Abstand detektiert werden kann.[14][15]
Backstep- oder Hopping-Modus
Der grundlegende Unterschied dieses Messmodus im Vergleich zu den oben genannten ist, dass dieser Modus Bildpunkt für Bildpunkt operiert, wohingegen die o. g. Modi Bildzeile für Bildzeile arbeiten.
Nach der erfolgten Annäherung der Messsonde an die zu untersuchende Probe wird die Sonde eine gewisse Strecke zurück gezogen und erst im Anschluss lateral positioniert und erneut an das Messobjekt angenähert. Diese Methodik erlaubt die Aufnahme von Objekten mit abrupt auftretenden, großen Höhenunterschieden. Da jedoch für jeden aufzunehmenden Bildpunkt eine komplette Annäherung an die Probe durchgeführt werden muss, ist dieser Messmodus im Vergleich zu den o. g. erheblich langsamer. Einige Verbesserungen der zeitlichen Auflösung wurden dadurch erreicht, dass nach einer ersten Aufnahme der Probe mit geringer Auflösung in einer anschließenden höher aufgelösten Messung die Strecke, die die Messsonde zurück gezogen wird, angepasst wurde[16][9]
Die Bezeichnung dieses Messmodus in der Literatur ist nicht einheitlich. Unter dem Namen backstep-mode wurde er zuerst 2002 verwendet[8]. Die in dieser Publikation demonstrierte laterale Auflösung entsprach jedoch ungefähr der von herkömmlichen Lichtmikroskopen. Die ersten Aufnahmen in diesem Modus, die eine Auflösung deutlich unterhalb der Beugungsgrenze boten[9] verwendeten die Bezeichnung hopping ion conductance microscopy bzw. hopping-mode. Kombinationen aus SICM und raster-elektrochemischer Mikroskopie benutzen den Begriff standing approach mode.[17]
Anwendungen
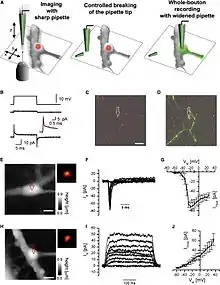
Es sind mehrere Übersichtsartikel erschienen, die die Möglichkeiten und Anwendungen des SICMs vorstellen.[13][19][20][21]
Da die SICM im Vergleich zu anderen sondenmikroskopischen Methoden wie der Rasterkraftmikroskopie die Probe weniger belastet[22], eignet sie sich insbesondere zur mehrfachen Bestimmung der Topographie auch lebender Zellen über einen längeren Zeitraum hinweg. Sie ermöglicht dabei zusätzlich die Bestimmung des Zellvolumens sowohl von Zellen, die einen dichten Zellrasen ausbilden[23], als auch für einzelne Zellen, die beispielsweise während der Zellmigration[24][25] oder des Zellwachstums[26] ihre Position über einen längeren Zeitraum verändern. Darüber hinaus ermöglicht die Applikation eines Drucks durch die Messsonde die Bestimmung des Elastizitätsmoduls lebender Zellen[26][27]. Außerhalb der Lebenswissenschaften kann die SICM dazu verwendet werden, die lokale Ladung von Oberflächen abzubilden[28] oder gezielt Moleküle zu einer Struktur auf einer Oberfläche abzuscheiden[29].
Die SICM kann mit unterschiedlichen anderen Techniken kombiniert werden. So ermöglichte die SICM in Kombination mit konfokaler Fluoreszenzmikroskopie die Lokalisierung ATP-abhängiger Kaliumkanäle in der Zellmembran[30], das Auffinden eines Mechanismus für das Abschnüren der Vesikel bei der Clathrin-vermittelten Endocytose[31] und eines Mechanismus zur Endozytose von Nanopartikeln[32]. In Kombination mit Förster-Resonanzenergietransfer-Messungen erlaubte es SICM zu zeigen, dass sich die Verteilung des β2-adrenergen Rezeptors in gesunden Zellen und Herzinsuffizienz-Zellmodellen unterscheidet[33].
Aufgrund der apparativen und technischen Ähnlichkeit zu elektrophysiologischen Messaufbauten wurde SICM mit Patch-clamp-Messungen kombiniert[34]. Durch das kontrollierte Abbrechen der Messsonde ist es möglich, zuerst hochauflösend die Topographie von Nervenzellen aufzunehmen und im Anschluss von subzelluklären Strukturen wie dendritischen Spines elektrophysiologisch abzuleiten.[18]
Literatur
- Andrew I. Shevchuk u. a.: An alternative mechanism of clathrin-coated pit closure revealed by ion conductance microscopy. In: The Journal of Cell Biology. Band 197, Nr. 4, 14. Mai 2012, S. 499–508, doi:10.1083/jcb.201109130, PMID 22564416 (Der Artikel ist inzwischen frei verfügbar und enthält einige kurze Videos von SICM-Aufnahmen in Kombination mit Fluoreszenzaufnahmen zur Endozytose.).
Einzelnachweise
- P.K. Hansma, B. Drake, O. Marti, S. A. Gould, C. B. Prater: The scanning ion-conductance microscope. In: Science. Band 243, Nr. 4891, 3. Februar 1989, ISSN 0036-8075, S. 641–643, doi:10.1126/science.2464851.
- M. Miragoli, A. Moshkov, P. Novak, A. Shevchuk, V. O. Nikolaev, I. El-Hamamsy, C. M. Potter, P. Wright, S. H. Kadir, A. R. Lyon, J. A. Mitchell, A. H. Chester, D. Klenerman, M. J. Lab, Y. E. Korchev, S. E. Harding, J. Gorelik: Scanning ion conductance microscopy: a convergent high-resolution technology for multi-parametric analysis of living cardiovascular cells. In: Journal of the Royal Society, Interface. Band 8, Nr. 60, Juni 2011, S. 913–925, doi:10.1098/rsif.2010.0597, PMID 21325316.
- Allen J. Bard, Fu Ren F. Fan, Juhyoun. Kwak, Ovadia. Lev: Scanning electrochemical microscopy. Introduction and principles. In: Analytical Chemistry. Band 61, Nr. 2, Januar 1989, ISSN 0003-2700, S. 132–138, doi:10.1021/ac00177a011.
- H. Nitz, J. Kamp, H. Fuchs: A Combined Scanning Ion Conductance and Shear Force Microscope. In: Probe Microscopy. Band 1, 1998, S. 187–200.
- Johannes Rheinlaender, Tilman E. Schäffer: Image formation, resolution, and height measurement in scanning ion conductance microscopy. In: Journal of Applied Physics. Band 105, Nr. 9, 2009, ISSN 0021-8979, S. 094905, doi:10.1063/1.3122007.
- Samantha Del Linz, Eero Willman, Matthew Caldwell, David Klenerman, Anibal Fernández, Guy Moss: Contact-Free Scanning and Imaging with the Scanning Ion Conductance Microscope. In: Analytical Chemistry. Band 86, Nr. 5, 4. März 2014, ISSN 0003-2700, S. 2353, doi:10.1021/ac402748j.
- Denis Thatenhorst, Johannes Rheinlaender, Tilman E. Schäffer, Irmgard D. Dietzel, Patrick Happel: Effect of Sample Slope on Image Formation in Scanning Ion Conductance Microscopy. In: Analytical Chemistry. Band 86, Nr. 19, 7. Oktober 2014, ISSN 0003-2700, S. 9838, doi:10.1021/ac5024414.
- S.A. Mann, G. Hoffmann, A. Hengstenberg, W. Schuhmann, I.D. Dietzel: Pulse-mode scanning ion conductance microscopy—a method to investigate cultured hippocampal cells. In: Journal of Neuroscience Methods. Band 116, Nr. 2, Mai 2002, ISSN 0165-0270, S. 113–117, doi:10.1016/S0165-0270(02)00023-7.
- Pavel Novak, Chao Li, Andrew I. Shevchuk, Ruben Stepanyan, Matthew Caldwell, Simon Hughes, Trevor G. Smart, Julia Gorelik, Victor P. Ostanin, Max J. Lab, Guy W. J. Moss, Gregory I. Frolenkov, David Klenerman, Yuri E. Korchev: Nanoscale live-cell imaging using hopping probe ion conductance microscopy. In: Nature Methods. Band 6, Nr. 4, 1. März 2009, ISSN 1548-7091, S. 279–281, doi:10.1038/nmeth.1306.
- Y. E. Korchev, M. .. Milovanovic, C. L. Bashford, D. C. Bennett, E. V. Sviderskaya, I. Vodyanoy, M. J. Lab: Specialized scanning ion-conductance microscope for imaging of living cells. In: Journal of Microscopy. Band 188, Nr. 1, Oktober 1997, ISSN 0022-2720, S. 17–23, doi:10.1046/j.1365-2818.1997.2430801.x.
- J. Gorelik, A. Shevchuk, M. Ramalho, M. Elliott, C. Lei, C. F. Higgins, M. J. Lab, D. Klenerman, N. Krauzewicz, Y. Korchev: Scanning surface confocal microscopy for simultaneous topographical and fluorescence imaging: Application to single virus-like particle entry into a cell. In: Proceedings of the National Academy of Sciences. Band 99, Nr. 25, 10. Dezember 2002, ISSN 0027-8424, S. 16018–16023, doi:10.1073/pnas.252458399.
- Yuri E. Korchev, Meera Raval, Max J. Lab, Julia Gorelik, Christopher R.W. Edwards, Trevor Rayment, David Klenerman: Hybrid Scanning Ion Conductance and Scanning Near-Field Optical Microscopy for the Study of Living Cells. In: Biophysical Journal. Band 78, Nr. 5, Mai 2000, ISSN 0006-3495, S. 2675–2679, doi:10.1016/S0006-3495(00)76811-1.
- Patrick Happel, Denis Thatenhorst, Irmgard Dietzel: Scanning Ion Conductance Microscopy for Studying Biological Samples. In: Sensors. Band 12, Nr. 12, Dezember 2012, ISSN 1424-8220, S. 14983–15008, doi:10.3390/s121114983.
- Andrew I. Shevchuk, Julia Gorelik, Sian E. Harding, Max J. Lab, David Klenerman, Yuri E. Korchev: Simultaneous Measurement of Ca2+ and Cellular Dynamics: Combined Scanning Ion Conductance and Optical Microscopy to Study Contracting Cardiac Myocytes. In: Biophysical Journal. Band 81, Nr. 3, September 2001, ISSN 0006-3495, S. 1759–1764, doi:10.1016/S0006-3495(01)75826-2.
- David Pastré, Hideki Iwamoto, Jie Liu, Gabor Szabo, Zhifeng Shao: Characterization of AC mode scanning ion-conductance microscopy. In: Ultramicroscopy. Band 90, Nr. 1, Dezember 2001, ISSN 0304-3991, S. 13–19, doi:10.1016/S0304-3991(01)00096-1.
- P. Happel, G. Hoffmann, S. A. Mann, I. D. Dietzel: Monitoring cell movements and volume changes with pulse-mode scanning ion conductance microscopy. In: Journal of Microscopy. Band 212, Nr. 2, November 2003, ISSN 0022-2720, S. 144–151, doi:10.1046/j.1365-2818.2003.01248.x.
- Yasufumi Takahashi, Yu Hirano, Tomoyuki Yasukawa, Hitoshi Shiku, Hiroshi Yamada, Tomokazu Matsue: Topographic, Electrochemical, and Optical Images Captured Using Standing Approach Mode Scanning Electrochemical/Optical Microscopy. In: Langmuir. Band 22, Nr. 25, Dezember 2006, ISSN 0743-7463, S. 10299–10306, doi:10.1021/la0611763.
- Pavel Novak, Julia Gorelik, Umesh Vivekananda, Andrew I. Shevchuk, Yaroslav S. Ermolyuk, Russell J. Bailey, Andrew J. Bushby, Guy W.J. Moss, Dmitri A. Rusakov, David Klenerman, Dimitri M. Kullmann, Kirill E. Volynski, Yuri E. Korchev: Nanoscale-Targeted Patch-Clamp Recordings of Functional Presynaptic Ion Channels. In: Neuron. Band 79, Nr. 6, September 2013, ISSN 0896-6273, S. 1067, doi:10.1016/j.neuron.2013.07.012.
- M. J. Lab, A. Bhargava, P. T. Wright, J. Gorelik: The scanning ion conductance microscope for cellular physiology. In: AJP: Heart and Circulatory Physiology. Band 304, Nr. 1, 1. Januar 2013, ISSN 0363-6135, S. H1–H11, doi:10.1152/ajpheart.00499.2012.
- D. Klenerman, A. Shevchuk, P. Novak, Y. E. Korchev, S. J. Davis: Imaging the cell surface and its organization down to the level of single molecules. In: Philosophical Transactions of the Royal Society B: Biological Sciences. Band 368, Nr. 1611, 24. Dezember 2012, ISSN 0962-8436, S. 20120027–20120027, doi:10.1098/rstb.2012.0027.
- Chiao-Chen Chen, Yi Zhou, Lane A. Baker: Scanning Ion Conductance Microscopy. In: Annual Review of Analytical Chemistry. Band 5, Nr. 1, 19. Juli 2012, ISSN 1936-1327, S. 207–228, doi:10.1146/annurev-anchem-062011-143203.
- Johannes Rheinlaender, Nicholas A. Geisse, Roger Proksch, Tilman E. Schäffer: Comparison of Scanning Ion Conductance Microscopy with Atomic Force Microscopy for Cell Imaging. In: Langmuir. Band 27, Nr. 2, 18. Januar 2011, ISSN 0743-7463, S. 697, doi:10.1021/la103275y.
- Yuri E. Korchev, Julia Gorelik, Max J. Lab, Elena V. Sviderskaya, Caroline L. Johnston, Charles R. Coombes, Igor Vodyanoy, Christopher R.W. Edwards: Cell Volume Measurement Using Scanning Ion Conductance Microscopy. In: Biophysical Journal. Band 78, Nr. 1, Januar 2000, ISSN 0006-3495, S. 451, doi:10.1016/S0006-3495(00)76607-0, PMID 10620308.
- Patrick Happel, Kerstin Möller, Nina K. Schwering, Irmgard D. Dietzel: Migrating Oligodendrocyte Progenitor Cells Swell Prior to Soma Dislocation. In: Scientific Reports. Band 3, 9. Mai 2013, ISSN 2045-2322, doi:10.1038/srep01806.
- Astrid Gesper, Denis Thatenhorst, Stefan Wiese, Teresa Tsai, Irmgard D. Dietzel, Patrick Happel: Long-term, long-distance recording of a living migrating neuron by scanning ion conductance microscopy. In: Scanning. Februar 2015, ISSN 0161-0457, doi:10.1002/sca.21200.
- Mario Pellegrino, Monica Pellegrini, Paolo Orsini, Elisabetta Tognoni, Cesare Ascoli, Paolo Baschieri, Franco Dinelli: Measuring the elastic properties of living cells through the analysis of current–displacement curves in scanning ion conductance microscopy. In: Pflügers Archiv - European Journal of Physiology. Band 464, Nr. 3, September 2012, ISSN 0031-6768, S. 307, doi:10.1007/s00424-012-1127-6.
- Johannes Rheinlaender, Tilman E. Schäffer: Mapping the mechanical stiffness of live cells with the scanning ion conductance microscope. In: Soft Matter. Band 9, Nr. 12, 2013, ISSN 1744-683X, S. 3230, doi:10.1039/C2SM27412D.
- Kim McKelvey, Sophie L. Kinnear, David Perry, Dmitry Momotenko, Patrick R. Unwin: Surface Charge Mapping with a Nanopipette. In: Journal of the American Chemical Society. Band 136, Nr. 39, Oktober 2014, ISSN 0002-7863, S. 13735, doi:10.1021/ja506139u.
- Kit T. Rodolfa, Andreas Bruckbauer, Dejian Zhou, Yuri E. Korchev, David Klenerman: Two-Component Graded Deposition of Biomolecules with a Double-Barreled Nanopipette. In: Angewandte Chemie International Edition. Band 44, Nr. 42, 28. Oktober 2005, ISSN 1433-7851, S. 6854, doi:10.1002/anie.200502338.
- Yuri E. Korchev, Yuri A. Negulyaev, Christopher R.W. Edwards, Igor Vodyanoy, Max J. Lab: Functional localization of single active ion channels on the surface of a living cell. In: Nature Cell Biology. Band 2, Nr. 9, 2000, ISSN 1465-7392, S. 616, doi:10.1038/35023563.
- A. I. Shevchuk, P. Novak, M. Taylor, I. A. Diakonov, A. Ziyadeh-Isleem, M. Bitoun, P. Guicheney, M. J. Lab, J. Gorelik, C. J. Merrifield, D. Klenerman, Y. E. Korchev: An alternative mechanism of clathrin-coated pit closure revealed by ion conductance microscopy. In: The Journal of Cell Biology. Band 197, Nr. 4, 14. Mai 2012, ISSN 0021-9525, S. 499, doi:10.1083/jcb.201109130.
- Pavel Novak, Andrew Shevchuk, Pakatip Ruenraroengsak, Michele Miragoli, Andrew J. Thorley, David Klenerman, Max J. Lab, Teresa D. Tetley, Julia Gorelik, Yuri E. Korchev: Imaging Single Nanoparticle Interactions with Human Lung Cells Using Fast Ion Conductance Microscopy. In: Nano Letters. Band 14, Nr. 3, 12. März 2014, ISSN 1530-6984, S. 1202, doi:10.1021/nl404068p.
- V. O. Nikolaev, A. Moshkov, A. R. Lyon, M. Miragoli, P. Novak, H. Paur, M. J. Lohse, Y. E. Korchev, S. E. Harding, J. Gorelik: β2-Adrenergic Receptor Redistribution in Heart Failure Changes cAMP Compartmentation. In: Science. Band 327, Nr. 5973, 25. März 2010, ISSN 0036-8075, S. 1653, doi:10.1126/science.1185988.
- Julia Gorelik, Yuchun Gu, Hilmar A. Spohr, Andrew I. Shevchuk, Max J. Lab, Sian E. Harding, Christopher R.W. Edwards, Michael Whitaker, Guy W.J. Moss, David C.H. Benton, Daniel Sánchez, Alberto Darszon, Igor Vodyanoy, David Klenerman, Yuri E. Korchev: Ion Channels in Small Cells and Subcellular Structures Can Be Studied with a Smart Patch-Clamp System. In: Biophysical Journal. Band 83, Nr. 6, Dezember 2002, ISSN 0006-3495, S. 3296, doi:10.1016/S0006-3495(02)75330-7.