Dornenfortsatz
Dornenfortsatz oder kurz Dorn – englisch spine – wird eine feine, oft pilzförmige Vorwölbung der Oberfläche einer Nervenzelle genannt, die sich überwiegend auf Dendriten von verschiedenen Neuronen des Gehirns findet. In den meisten Fällen stellt die Zellmembran an der ausgestülpten Fortsatzspitze eine postsynaptische Region (Postsynapse) hervorgehoben dar, auf die ein vorgeschaltetes Neuron mit einer präsynaptischen Axonendigung (Präsynapse) Erregungen überträgt, die hier in exzitatorische Signale überführt werden.[1]
| Übergeordnet |
| Dendrit |
| Gene Ontology |
|---|
| QuickGO |
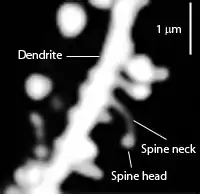
Dornenfortsätze treten bei allen Wirbeltieren im zentralen Nervensystem auf. Im menschlichen Gehirn enden exzitatorische Synapsen meistens auf dendritischen Dornen, anatomisch Spinula [s. Gemmula] dendritica[2] genannt. Manche Nervenzellen tragen Tausende solcher Fortsatzbildungen, je etwa 0,2 bis 2 µm lang, bei denen ein unterschiedlich dicker Kopf (engl. head) vom schmaleren Hals (engl. neck) abgesetzt sein kann. Doch kommen Dornenfortsätze nicht nur auf Dendriten vor.[1] Form, Größe und biochemische Besonderheiten der Dornen beeinflussen die Signalübertragung an Synapsen.
Ein Dorn kann ausgebildet werden, sich in Abhängigkeit von der synaptischen Aktivität verändern und verschiedene Formen annehmen (morphologische Plastizität), sowie rückgebildet werden. Diese Strukturänderungen nehmen Einfluss auf die funktionellen Bedingungen einer Synapse (synaptische Plastizität) und können kurzzeitig, länger andauernd oder langfristig anhaltend (späte Langzeit-Potenzierung LTP) zu Verstärkungen von synaptischen Verknüpfungen führen (mögliche Korrelate des Langzeitgedächtnisses).[1]
Pilzförmig entwickelte Dornen (engl. mushroom spines) enthalten häufig zusätzlich einen sogenannten Dornenapparat, der vermutlich als Calcium-Speicher für intrazelluläre Ca2+-Signalwege Bedeutung hat, jedoch noch nicht verstanden ist.
Aussehen und Vorkommen

Dornenfortsätze wurden bereits 1888 von R. Cajal im Kleinhirn von Vögeln beschrieben[3] und sind beim Menschen sowohl auf Purkinjezellen der Kleinhirnrinde wie auf Pyramidenzellen der Großhirnrinde – archikortikal insbesondere im Hippokampus – zu finden sowie noch in weiteren Hirnregionen, beispielsweise subkortikal (siehe Abbildung oben) oder im Thalamus. Zumeist wachsen Dornen aus den Dendriten einer Nervenzelle hervor, sie können jedoch auch auf deren Soma oder im Bereich des Axonhügels gebildet werden.[1]
Dendritische Dornen treten unterschiedlich dicht verteilt in verschiedenen Formen und Größen der Vorwölbungen auf. Oft wachsen sie mit einem schmalen Hals empor und enden mit einem mehr oder weniger voluminösen Kopf („Endköpfchen“). Dieser trägt eine postsynaptische dichte (PSD-)Membranregion mit Transmitterrezeptoren, Ionenkanälen und signalübermittelnden Systemen. Dem gegenüber befindet sich die präsynaptische Region des anderen Neurons, zumeist auf einem „Endknöpfchen“. Allein nach dem Aussehen der Fortsätze werden grob verschiedene Typen unterscheiden, die Übergänge sind jedoch fließend:[4]
- Filopodien: Sehr lange, fadenförmige Ausstülpungen ohne Kopf. Solche Filopodien werden auch als Vorstufe dendritischer Verzweigungen angesehen und können mehrere Synapsen tragen.
- Dünne Dornen (engl. thin spines): Dornen mit engem, langem Hals und klar abgesetztem Kopf
- Pilzförmige Dornen (engl. mushroom spines): Dornen mit einem schmalen Hals und einem voluminösen, kugeligen Kopf
- Aufsitzende Dornen (engl. sessile spines): Dornen ohne einen deutlich abgrenzbaren Hals
- Stummelförmige Dornen (engl. stubby spines): Kurz, ohne Unterschied von Hals und Kopf
Über die für das bewegliche Zytoskelett aus F-Aktin formbestimmenden Faktoren eines Dorns ist im Einzelnen bisher noch wenig bekannt. Man nimmt an, dass über die Form auf die Signalübertragung der zugehörigen Synapse Einfluss genommen wird (→Funktion), ein Teilraum der Nervenzelle abgegrenzt und als Subkompartiment mit besonderen biochemischen Bedingungen gestaltet werden kann. Darüber hinaus wurde nachgewiesen, dass dendritische Dornen nicht dauerhaft einem bestimmten Typ zugehören, sondern ihre Form ändern (morphologische Plastizität), eventuell auch im Laufe der Zeit im Sinne eines Lebenszyklus von Dornen.[1] Je größer ein Dornenfortsatz ist, desto höher ist gemeinhin die Zahl an Rezeptor-Molekülen für den Neurotransmitter in der postsynaptischen Membranregion (PSD).[5]
Funktion und Formdifferenzierung
Dornen sind anpassbare Strukturen, spezialisiert auf die synaptische Transmission und die Umbildung postsynaptischer Signale in besondere Veränderungen der Form, abhängig von der synaptischen Aktivität. Sie können die Erregungsübertragung und Signalweitergabe in mehrerer Hinsicht beeinflussen:
- Oberflächenvergrößerung: Dendritische Dornen vergrößern die Oberfläche von Dendriten und sorgen so dafür, dass mehr Synapsen auf ihnen Platz finden können. Außerdem verkürzen sie die Weglänge, die Axone zurücklegen müssen.[6]
- Elektrischer Widerstand: Der enge „Hals“ dendritischer Dornen stellt möglicherweise einen elektrischen Widerstand dar, da Ionen diesen Engpass nicht so leicht passieren können. Dadurch könnte das elektrische Signal an Synapsen verstärkt werden. Diese Hypothese ist jedoch umstritten.
- Biochemische Kompartimentierung: Als Ausstülpungen von Dendritenoberflächen bilden sie separate Einheiten, die jeweils nur über eine mehr oder weniger schmale „Brücke“ mit dem restlichen Dendriten in Verbindung stehen. Sie behindern damit die Diffusion von Molekülen in oder aus einem Fortsatz und ermöglichen so, dass Veränderungen zunächst auf einzelne Postsynapsen beschränkt bleiben.[7]
Mit dem Dornenfortsatz wird ein postsynaptisches Element hervorgehoben und als ein Teilraum abgesetzt, der abhängig von seiner synaptischen Aktivität verschieden gestaltet werden kann. Durch das formende Zytoskelett aus Aktinfilamenten können Dornenfortsätze nach Breite der Basis, Länge des Halses und Größe des Kopfes in unterschiedlicher Form ausgebildet werden. Während die jeweilige räumliche Gestalt der Membranhülle Einfluss auf die Fortleitung elektrischer Potentialänderungen hat, kann der abgeteilte Raum als Kompartimentierung für biochemische Signalprozesse – beispielsweise rasch kurzzeitig erhöhte intrazelluläre Ca2+-Spiegel – verstanden werden.[1] Insbesondere pilzförmig entwickelte Dornen (engl. mushroom spines) auf Neuronen des Großhirns – nicht aber des Kleinhirns – enthalten im plasmatischen Innenraum häufig zusätzlich als spezifisches Organell einen Dornenapparat, der aus einigen Lamellen glatten endoplasmatischen Retikulums besteht, vermutlich als Calcium-Speicher dient[8] und in unterschiedlicher Weise verschiedene Formen synaptischer Plastizität beeinflussen kann.[9]
Literatur
- Eric R. Kandel, J. H. Schwartz, T. M. Jessell: Neurowissenschaften. Eine Einführung. Spektrum Akad. Verl., Heidelberg 1996. ISBN 3-86025-391-3
- R. F. Thompson: Das Gehirn. Von der Nervenzelle zur Verhaltenssteuerung. Spektrum Akad. Verl., Heidelberg 2001. ISBN 3-8274-1080-0
- J. Dudel, R. Menzel, Robert Franz Schmidt: Neurowissenschaft. Vom Molekül zur Kognition. Springer, Berlin 2001. ISBN 3-540-41335-9
Einzelnachweise
- E.A. Nimchinsky u. a.: Structure and function of dendritic spines in Annual Review of Physiology. Harvard 2002, 64, S. 313–353, als PDF (englisch) (Memento des Originals vom 27. September 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- Isabell Lockard: Desk Reference for Neuroscience. Springer S.& B.M., 2012, ISBN 9781461228028, S. 247.
- Ramón y Cajal, S. Estructura de los centros nerviosos de las aves. Rev. Trim. Histol. Norm. Pat. 1, 1–10 (1888).
- K. E. Sorra u. a., in: The international journal of neuroscience. London 1998, 18, S. 658. ISSN 0020-7454
- Z. Nusser u. a., in: Neuron. Cambridge 1998, 21, S. 545. ISSN 0896-6273
- T. Bonhoeffer, R. Yuste, in: Neuron. Cambridge 2002, 35, S. 1019. ISSN 0896-6273
- B. L. Sabatini u. a., in: Current opinion in neurobiology. Oxford 2001, 11, S. 349. ISSN 0959-4388
- M. Segal, E. Korkotian: Synaptopodin regulates release of calcium from stores in dendritic spines of cultured hippocampal neurons. In: The Journal of Physiology. Band 589, Nr. 24, 2011, S. 5987–5995, doi:10.1113/jphysiol.2011.217315, PMID 22025667.
- P. Jedlicka, A. Vlachos, S.W. Schwarzacher, T. Deller: A role for the spine apparatus in LTP and spatial learning. In: Behavioural Brain Research. Band 192, Nr. 1, 2008, S. 12–19, doi:10.1016/j.bbr.2008.02.033, PMID 18395274.