Pyrithion
Pyrithion ist eine organische Verbindung. Sie besteht aus einem Pyridinring, welcher am Stickstoffatom oxidiert ist (Pyridin-N-oxid) und in 2-Position eine Thiocarbonylfunktion trägt. Es ist ein Fungizid und Bakterizid.[3]
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
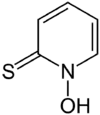 | ||||||||||
| Allgemeines | ||||||||||
| Name | Pyrithion | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C5H5NOS | |||||||||
| Kurzbeschreibung |
beigefarbener bis grau-schwarzer Feststoff mit üblem Geruch[1][2] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 127,18 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Siedepunkt | ||||||||||
| Löslichkeit |
schwer löslich in Wasser (2,5 g·l−1 bei 20 °C)[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Darstellung
Zur Herstellung der Verbindung wird zunächst 2-Chlorpyridin-N-oxid mit Natriumhydrogensulfid zur Reaktion gebracht, woraus das Natriumsalz des Pyrithions entsteht. Pyrithion kann hieraus durch Neutralisation mit Säuren freigesetzt werden.[3]
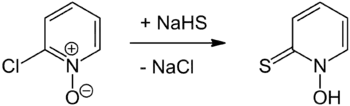
Eigenschaften
Pyrithion ist ein übel riechender Feststoff,[2] der bei 69–72 °C schmilzt.[1] Er besitzt nur eine geringe Wasserlöslichkeit von 2,5 g·l−1 bei 20 °C.[1]
Es liegt ein Gleichgewicht zwischen den tautomeren Enthiol- und Thionformen vor (Thiolactam-Thiolactim-Tautomerie).[3]

Verwendung
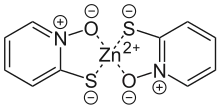
Pyrithion kann zur Herstellung von Zink-Pyrithion verwendet werden, welches zur Anwendung gegen Hautschuppen[5] und in pilzhemmenden Anstrichen verwendet wird. Natrium-Pyrithion, das als Antimykotikum verwendet wird, kann durch Reaktion mit Natriumsalzen hergestellt werden.[3] Die Herstellung des Bakterizids und Fungizids Dipyrithion gelingt durch oxidative Dimerisierung.[3]
Ebenfalls kann Pyrithion zur Herstellung von Copolymeren der Cellulose verwendet werden. Diese Polymerisation verläuft radikalisch.[3]
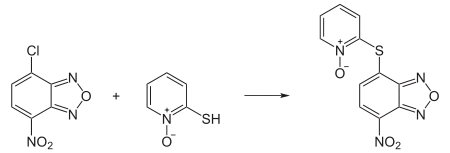
In der Chemie wird Pyrithion zur Herstellung von Barton-Estern, die zur Barton-McCombie-Decarboxylierung benötigt werden, eingesetzt. Derivatisiert mit 4-Chlor-7-nitrobenzo-2-oxa-1,3-diazol (NDB-Cl) dient Pyrithion in der chemischen Analytik zur UV-Fluoreszenz-Detektion in HPLC-Messungen.
Einzelnachweise
- Datenblatt Pyrithion bei AlfaAesar, abgerufen am 6. Juni 2010 (PDF) (JavaScript erforderlich).
- Datenblatt Pyrithion bei Acros, abgerufen am 6. Juni 2010.
- Eintrag zu Pyrithion. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. Juni 2014.
- Datenblatt 2-Mercaptopyridine N-oxide bei Sigma-Aldrich, abgerufen am 22. April 2011 (PDF).
- C. J. Chandler, I. H. Segel: „Mechanism of the antimicrobial action of pyrithione: effects on membrane transport, ATP levels, and protein synthesis“, in: Antimicrob. Agents Chemother., 1978, 14, S. 60–68; PMC 352405 (freier Volltext, PDF).
