Pyridiniumchlorid
Pyridiniumchlorid ist ein beiges bis weißes Salz, das sich vom Pyridin ableitet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
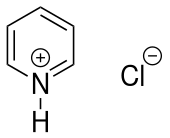 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Pyridiniumchlorid | ||||||||||||||||||
| Andere Namen |
Pyridinhydrochlorid | ||||||||||||||||||
| Summenformel | C5H6NCl | ||||||||||||||||||
| Kurzbeschreibung |
beiger, geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 115,56 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Schmelzpunkt |
145–147 °C[2] | ||||||||||||||||||
| Siedepunkt |
222–224 °C[2] | ||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser (85 g·l−1)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Herstellung
Pyridiniumchlorid kann durch eine Neutralisationsreaktion zwischen Pyridin (Base) und Chlorwasserstoff (Säure) gebildet werden. Dabei kann der gasförmige Chlorwasserstoff durch eine etherische Pyridinlösung geleitet werden. Das Hydrochlorid-Salz fällt aus.[3]
Eigenschaften
Pyridiniumchlorid ist mit einem pKs-Wert von 5,2 eine mittelstarke Säure.[4] Es ist in Wasser, Methanol und Ethanol löslich.[1][2]
Verwendung
Pyridiniumchlorid kann genutzt werden, um Epoxide in Chlorhydrine zu überführen. Es stellt eine milde Alternative für die Abspaltung der Methylgruppe aus Anisolen dar und kann als Katalysator in der Fischer-Indol-Synthese verwendet werden.[3]
Einzelnachweise
- Datenblatt Pyridine hydrochloride bei AlfaAesar, abgerufen am 29. Oktober 2021 (PDF) (JavaScript erforderlich).
- Datenblatt Pyridin -hydrochlorid bei Sigma-Aldrich, abgerufen am 29. Oktober 2021 (PDF).
- Michael W. Wilson: Pyridinium Chloride. In: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester, UK 2001, ISBN 978-0-471-93623-7, S. rp287m, doi:10.1002/047084289x.rp287m.
- Frederick G. Bordwell: Equilibrium acidities in dimethyl sulfoxide solution. In: Accounts of Chemical Research. Band 21, Nr. 12, 1. Dezember 1988, S. 456–463, doi:10.1021/ar00156a004.
