Pseudokapazität
Eine Pseudokapazität speichert elektrische Energie mit Hilfe von reversiblen Redoxreaktionen an dafür geeigneten Elektroden eines elektrochemischen Kondensators (Superkondensators) mit einer Helmholtz-Doppelschicht.[1] Die Redoxreaktionen sind verbunden mit einem faradayschen Ladungstausch aus den Ionen im Elektrolyten an die metallisch leitenden Ionen in der Elektrode. Dabei ist jeweils nur ein Elektron aus einem desolvatierten und adsorbierten Ion beteiligt. Das adsorbierte Ion geht keine chemische Bindung mit der Elektrode ein. Es findet nur ein Elektronentransfer statt.
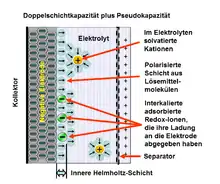
Eine Pseudokapazität tritt immer nur zusammen mit einer Doppelschichtkapazität auf. Sie summieren sich in allen elektrochemischen Kondensatoren (Superkondensatoren) untrennbar zu einer Gesamtkapazität. Sie haben jedoch, je nach Ausführung der Elektroden, einen stark unterschiedlichen Anteil an der Gesamtkapazität. Die Pseudokapazität einer dafür geeigneten Elektrode kann beispielsweise bei gleicher Oberfläche der Elektrode um den Faktor 100 größer sein als die Doppelschichtkapazität.[2][3][4]
Die Ladungsmenge der in einer Pseudokapazität gespeicherten Energie verhält sich linear zur anliegenden Spannung. Die Einheit der Pseudokapazität ist Farad.
Historie
Zur Historie der theoretischen Modelle zur Pseudokapazität siehe Elektrochemische Doppelschicht.
Zur Historie der Entwicklung der elektrochemischen Kondensatoren siehe Superkondensator.
Funktionsweise der elektrochemischen Pseudokapazität
_NT-int.svg.png.webp)
1. Innere Helmholtz-Schicht (englisch inner Helmholtz plane, IHP),
2. Äußere Helmholtz-Schicht (englisch outer Helmholtz plane, OHP),
3. Diffuse Schicht,
4. solvatisierte Kationen,
5. desolvatisiertes und adsorbiertes Anion (Redox-Ion, das zur Pseudokapazität beiträgt),
6. Moleküle des Elektrolyt-Lösungsmittels
Redoxreaktionen mit faradayschen Ladungstausch sind aus Akkumulatoren seit Dekaden bekannt. Aber diese chemischen Prozesse sind verbunden mit festen chemischen Bindungen des Elektrodenmaterials mit einem Adsorbat aus dem Elektrolyten. Obwohl die chemischen Prozesse relativ reversibel sind, hinterlassen die Lade-/Entladezyklen in Akkus irreversible chemische Verbindungen, die die Speicherfähigkeit und damit die Lebensdauer begrenzen. Außerdem verlaufen die chemischen Reaktionen in Akkus recht langsam, so dass für das Laden-/Entladen eine längere Zeit benötigt wird.
Pseudokapazitive Redoxreaktionen in elektrochemischen Kondensatoren (Superkondensatoren) verlaufen anders. Sie erfolgen mit einer physikalischen Adsorption (Physisorption) eines geladenen Moleküls oder Atoms (Ions) auf der Elektrodenoberfläche und ähnelt einer chemischen Gleichgewichtsreaktion. Der adsorbierte Stoff (Adsorbat) bildet jedoch mit der Oberfläche keine chemische Bindung aus,[5] sondern haftet durch schwächere Kräfte ähnlich der Adhäsion. So treten in der Regel nur Van-der-Waals-Kräfte auf. Die zu adsorbierenden Ionen müssen dabei zunächst die trennende Wirkung der elektrochemischen Doppelschicht[1] im Superkondensator überwinden. Dabei verlieren sie die umgebende Solvathülle. Bei der dann folgenden Adsorption der Ionen aus dem Elektrolyten findet ein faradayscher Ladungstausch an der Oberfläche der dafür geeigneten Elektrode statt. An den Redoxreaktionen ist jeweils nur ein Elektron beteiligt. Es findet nur ein Elektronentransfer (Ein-Elektronenaustauschreaktion) statt. Bei diesen outer-sphere-Redoxreaktionen werden keine Bindungen geknüpft oder gebrochen. Dieser Prozess ist reversibel, d. h. beim Entladen des Kondensators findet der Elektronentransfer in umgekehrter Richtung statt.
Die Fähigkeit von Kondensatorelektroden, Redoxreaktionen für eine Pseudokapazität zu bewerkstelligen, hängt sehr stark von der Beschaffenheit und der Struktur des Elektrodenmaterials ab. Elektrodenmaterialien, die pseudokapazitive Eigenschaften aufweisen sind z. B. Metalloxide von Übergangsmetallen, die die zum Teil durch Dotierung in das Elektrodenmaterial eingebracht oder mit Hilfe einer Interkalation eingefügt werden. Auch leitfähige Polymere wie Polyanilin oder Derivate von Polythiophen, die auf die Strukturen von Kohlenstoffelektroden aufgebracht sind, eignen sich für Pseudokondensatoren. Aber auch Kohlenstoffelektroden können eine Pseudokapazität aufweisen.[6] Der Anteil an pseudokapazitiven Reaktionen an Kohlenstoffelektroden kann auch durch maßgeschneiderte Porengrößen deutlich gesteigert werden.[7]
Es können drei Arten der elektrochemischen Energiespeicherung mit einem Elektronentransfer, der zu einer Pseudokapazität führt, in Superkondensatoren auftreten:[8][9]
- Redoxreaktionen (Reduktions-Oxidations-Reaktionen) mit spezifisch adsorbierten Ionen aus dem Elektrolyten auf den Oberflächen der Elektroden
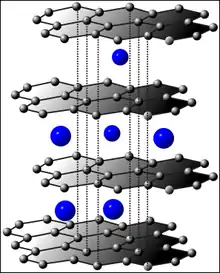
- Interkalation, Einfügung von Atomen in die Gitterstruktur der Elektrode
- Elektrosorption, unterpotentielle Deposition von Wasserstoffatomen oder metallischen Ad-Atomen in Oberflächen-Gitterplätzen der Elektroden-Gitterstruktur
Beschreibung der Systemarten, die zur Pseudokapazität beitragen:[8]
- Redox System: Ox + ze‾ ⇌ Red und O2‾ + H ˡ ⇌ im Gitter
- Interkalationssystem: Liˡ in "Ma2"
- Elektrosorption, unterpotentielle Deposition von Metall-Adatomen: M꞊ ˡ + S + ze‾ ⇌ SM oder H ˡ e‾ + S ⇌ SH (S = Oberflächengitterplätze)
Am besten erforscht und verstanden ist die Pseudokapazität bei Rutheniumoxid (RuO2).[2] Hier kommt es zu einer gekoppelten reversiblen Redoxreaktion mit mehreren Oxidationsstufen, deren Potenziale sich überlappen. Die Elektronen kommen meist aus den Valenzorbitalen des Elektrodenmaterials und die Elektronentransferreaktion geschieht sehr schnell, wobei nach folgender Reaktionsgleichung hohe Ströme fließen können:[10]
Bei diesem Charge-Transfer-Übergang (Ladungs-Transfer-Übergang) werden beim Laden bzw. Entladen H+ Protonen in das Ruthenium-Kristallgitter eingelagert bzw. aus ihm entfernt. Es erfolgt eine faradaysche bzw. elektrochemische Speicherung elektrischer Energie ohne chemische Umwandlung des Elektrodenmaterials. Die OH-Gruppen lagern sich als molekulare Schicht an die Elektrodenoberfläche an. Da die messbare Spannung aus der Redoxreaktion proportional zu dem Ladungszustand ist, entspricht das Verhalten der Reaktion dem eines Kondensators und nicht dem eines Akkumulators, bei der die Spannung weitgehend unabhängig vom Ladezustand ist.
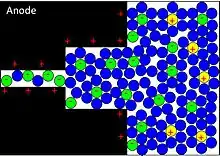
Diese Elektronenaustauschreaktionen sind sehr schnell, sehr viel schneller als die chemischen Prozesse in Akkus. Bei diesen reversiblen Reaktionen wird jeweils ein Elektron an die Oberflächenatome der negativen Elektrode abgegeben. Dieses Elektron fließt über den externen Stromkreis zur positiven Elektrode. Gleichzeitig wandern gleich viele Anionen durch den Elektrolyten von der negativen zur positiven Elektrode. Dort, in Elektroden aus Übergangsmetalloxiden, nehmen aber nicht die sich angereicherten Anionen das Elektron wieder auf, sondern die dort vorhandenen und im geladenen Zustand stark ionisierten und daher recht „elektronenhungrigen“ Übergangsmetallionen. Da bei diesen pseudokapazitiven Reaktionen keine festen chemischen Verbindungen entstehen, können sie theoretisch unbegrenzt wiederholt werden. Das ist die Begründung für die sehr hohe Zyklusfestigkeit vieler Superkondensatoren mit hoher Pseudokapazität.
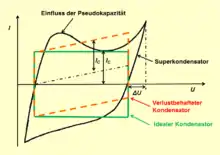
Die pseudokapazitive Eigenschaft eines Superkondensators kann mit einem sogenannten „zyklischen Voltammogramm“, der Aufzeichnung des Stromverlaufes bei sich zyklisch ändernder Spannung, erkannt werden. Die Stromkurve eines Pseudokondensators unterscheidet sich deutlich von derjenigen eines idealen oder eines verlustbehafteten Kondensators mit reiner statischer Speicherung. Das Voltammogramm eines idealen Kondensators verläuft rechteckig. Für einen verlustbehafteten Kondensator verschiebt sich die Kurve zu einem Parallelogramm. Bei Elektroden mit faradayschen Austauschreaktionen ist die elektrische Ladung, die in dem Kondensator gespeichert ist, stark abhängig vom Potential der Elektrode. Weil das abweichende Potential der Elektrode gegenüber dem Potential bei der voltammetrischen Messung beim Rückwärtsfahren eine Verspätung verursacht, weicht das Voltammogramm eines Pseudokondensators von der Form des Parallelogramms ab, siehe Diagramm rechts.[4][11]
Wie bei Doppelschichtelektroden ergibt sich das Speichervermögen von Pseudokondensatorelektroden aus dem potentialabhängigen Bedeckungsgrad der Elektrodenoberfläche mit adsorbierten Ionen. Da bei allen pseudokapazitiv wirksamen Reaktionen die Ionen desolvatisiert sind, d. h. keine die kugelförmig umhüllende Schicht von Lösungsmittelmolekülen aufweisen, sind sie deutlich kleiner als die solvatisierten Ionen, die zur Doppelschichtkapazität beitragen. Deshalb benötigen sie entsprechend weniger Elektrodenoberfläche, wodurch erklärt wird, dass bei gleicher Elektrodenoberfläche sehr viel mehr Pseudokapazität als Doppelschichtkapazität entstehen kann.[12][7][13] Dieses potentialabhängige Speichervermögen auch der Pseudokapazität bewirkt, dass im Gegensatz zum Spannungsverhalten von Akkumulatoren, die eine nahezu ladungsunabhängige Spannungskurve besitzen, Superkondensatoren einen linearen Verlauf der Kondensatorspannung in Abhängigkeit von der gespeicherten Ladung aufweisen.
In realen elektrochemischen Kondensatoren ist die am Kondensator messbare Kapazität immer eine Kombination aus Doppelschicht- und Pseudokapazität. Beide Speicherarten sind untrennbar miteinander verbunden und lediglich durch die Kurvenform des Cyclovoltammogramms zu erkennen. Der Anteil an Pseudokapazität einer Elektrode, sofern sie aus einem pseudokapazitiv wirksamen Material wie den Übergangsmetalloxiden oder den leitfähigen Polymeren besteht, kann bei gleicher Elektrodenoberfläche und gleichem Volumen, einen um den Faktor 10 bis zu 100 größeren Wert haben als die der Doppelschichtkapazität.[14][4]
Kondensatoren, deren Kapazität überwiegend aus elektrochemischen Reaktionen stammt, heißen Pseudokondensatoren.[2][15][16] Handelsübliche Superkondensatoren mit sehr hoher Pseudokapazität kombinieren eine pseudokapazitive Elektrode mit einer Doppelschichtelektrode und sind der Familie der Hybridkondensatoren zuzuordnen.
Literatur
- Héctor D. Abruña, Yasuyuki Kiya, Jay C. Henderson: Batteries and electrochemical capacitors. In: Physics Today. Nr. 12, 2008, S. 43–47 (Online [PDF]).
- F. Béguin, E. Raymundo-Piñero, E. Frackowiak: Carbons for Electrochemical Energy Storage and Conversion Systems. Chapter 8: Electrical Double-Layer Capacitors and Pseudocapacitors. CRC Press, 2009, ISBN 978-1-4200-5307-4, S. 329–375, doi:10.1201/9781420055405-c8
- J. O'M. Bockris, M. A. V. Devanathan, K. Muller: On the Structure of Charged Interfaces. In: Proceedings of the Royal Society. Band 274, Nr. 1356, 1963, S. 55–79, doi:10.1098/rspa.1963.0114.
- B. E. Conway: Electrochemical Supercapacitors: Scientific Fundamentals and Technological Applications. Springer, Berlin 1999, ISBN 0-306-45736-9 (eingeschränkte Vorschau in der Google-Buchsuche).
- K. W. Leitner, M. Winter, J. O. Besenhard: Composite supercapacitor electrodes. In: Journal of Solid State Electrochemistry. Springer-Verlag, Volume 8, 2003, Issue 1, S. 15–16, doi:10.1007/s10008-003-0412-x
- Volkmar M. Schmidt: Elektrochemische Verfahrenstechnik. Grundlagen, Reaktionstechnik, Prozessoptimierung. Wiley-VCH, Weinheim 2003, ISBN 3-527-29958-0, Kapitel 7 - Elektrochemische Energietechnik, S. 539–639 (eingeschränkte Vorschau in der Google-Buchsuche).
- Yu. M. Volfkovich, T. M. Serdyuk: Electrochemical Capacitors. In: Russian Journal of Electrochemistry. September 2002, Volume 38, Issue 9, Kluwer Academic Publishers-Plenum Publishers, S. 935–959, doi:10.1023/A:1020220425954.
- Jiujun Zhang, Lei Zhang, Hansan Liu, Andy Sun, Ru-Shi Liu: Electrochemical Technologies for Energy Storage and Conversion. Band 1. Wiley-VCH, Weinheim 2011, ISBN 978-3-527-32869-7, Kapitel 8 - Electrochemical Supercapacitors, S. 317–376 (eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
- Zbigniew Stojek: The Electrical Double Layer and Its Structure. In: Fritz Scholz (Hrsg.): Electroanalytical Methods: Guide to Experiments and Applications. Springer, Berlin/Heidelberg 2010, ISBN 978-3-642-02914-1, S. 3–10 (online).
- B. E. Conway: Electrochemical Supercapacitors: Scientific Fundamentals and Technological Applications. Springer, Berlin 1999, ISBN 0-306-45736-9, S. 1–8 (eingeschränkte Vorschau in der Google-Buchsuche). Siehe auch unter Brian E. Conway in Electrochemistry Encyclopedia: ELECTROCHEMICAL CAPACITORS Their Nature, Function, and Applications (Memento vom 30. April 2012 im Internet Archive) (abgerufen am 7. Dezember 2015)
- Marin S. Halper, James C. Ellenbogen: Supercapacitors: A Brief Overview. (PDF) In: MITRE Nanosystems Group. März 2006, abgerufen am 14. Mai 2013 (englisch).(zuletzt abgerufen am 27. Juli 2013)
- E. Frackowiak, F. Beguin: Carbon Materials For The Electrochemical Storage Of Energy In Capacitors. In: CARBON. 39, 2001, S. 937–950, doi:10.1016/S0008-6223(00)00183-4. (Review) und E. Frackowiak, K. Jurewicz, S. Delpeux, F. Béguin: Nanotubular Materials For Supercapacitors. In: Journal of Power Sources. Volumes 97–98, Juli 2001, S. 822–825, doi:10.1016/S0378-7753(01)00736-4
- Josie Garthwaite: How ultracapacitors work (and why they fall short). In: Earth2Tech. GigaOM Network, 12. Juli 2011, abgerufen am 28. Juli 2013.
- Roy Peter Richner: Entwicklung neuartig gebundener Kohlenstoffmaterialien für elektrische Doppelschichtkondensatorelektroden. DISS. ETH Nr. 14413, 2001, doi:10.3929/ethz-a-004386636
- B. P. Bakhmatyuk, B. Y. Venhryn, I. I. Grygorchak, M. M. Micov, S. I. Mudry: Intercalation Pseudo-Capacitance In Carbon Systems Of Energy Storage. In: Rev. Adv. Mater. Sci. Band 14, 2007, S. 151–156 (PDF).
- B. E. Conway, W. G. Pell: Double-layer and pseudocapacitance types of electrochemical capacitors and their applications to the development of hybrid devices. In: Journal of Solid State Electrochemistry. Band 7, Nr. 9, September 2003, S. 637–644, doi:10.1007/s10008-003-0395-7.
- B. E. Conway, V. Birss, J. Wojtowicz: The role and utilization of pseudocapacitance for energy storage by supercapacitors. In: Journal of Power Sources. Band 66, Nr. 1–2, Mai 1997, S. 1–14, doi:10.1016/S0378-7753(96)02474-3.
- P. Simon, Y.Gogotsi,ifc.dicp.ac.cn (PDF; 1,0 MB) Materials for electrochemical capacitors, nature materials, VOL 7, NOVEMBER 2008.
- electronics.stackexchange.com Why does an ideal capacitor give rise to a rectangular cyclic voltammogram (CV)?
- A.G. Pandolfo, A.F. Hollenkamp: Carbon properties and their role in supercapacitors. In: Journal of Power Sources. Band 157, Nummer 1, 2006, S. 11–27, doi:10.1016/j.jpowsour.2006.02.065. (Review)
- P. Simon, A. Burke: Nanostructured carbons: Double-Layer capacitance and more. electrochem.org (PDF; 633 kB)
- B. E. Conway: Transition from ‘Supercapacitor’ to ‘Battery’ Behavior in Electrochemical Energy Storage. In: Journal of The Electrochemical Society. Band 138, Nr. 6, Mai 1991, S. 1539–1548, doi:10.1149/1.2085829. (PDF)
- Adam Marcus Namisnyk and J. G. Zhu: A Survey of Electrochemical Super-Capacitor Technology. 2003 (PDF [abgerufen am 7. Dezember 2015] Bachelor-Arbeit; University of Technology, Sydney; 2003).
- A. K. Shukla, S. Sampath, K. Vijayamohanan: Electrochemical supercapacitors: Energy storage beyond batteries. In: Current science. Band 79, Nr. 12, 2000, S. 1656–1661 (PDF).