Perbromsäure
Als Perbromsäure wird die Sauerstoffsäure des Broms in der Oxidationsstufe +7 mit der Summenformel HBrO4 bezeichnet. Ihre Salze heißen Perbromate.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
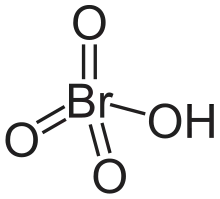 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Perbromsäure | ||||||||||||
| Andere Namen |
Brom(VII)-säure | ||||||||||||
| Summenformel | HBrO4 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 144,91 g·mol−1 | ||||||||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Darstellung
Das erste Mal wurde Perbromsäure durch den radioaktiven Zerfall eines Selenatsalzes mit radioaktivem 83Se hergestellt:
Das durch β-Zerfall entstandene 83BrO4− zerfällt hierbei in einem weiteren β-Zerfall zu Krypton und Sauerstoff.
Im Gegensatz zur Perchlorsäure lässt sich Perbromsäure nicht durch thermische Disproportionierung von Bromsäure erhalten. Sie kann nur durch sehr starke Oxidationsmittel, wie molekulares Fluor oder Xenondifluorid, aus Bromat-haltigen Lösungen hergestellt werden, ebenso durch anodische Oxidation.[1]
Eigenschaften
Bis zu einer Konzentration von 6 mol/l kann Perbromsäure zersetzungsfrei konzentriert werden, es können aber auch höhere Konzentrationen hergestellt werden. Perbromsäure ist ein sehr starkes (Standardpotential für Perbromat → Bromat im Sauren: +1,853 V[1]), jedoch in verdünnter Lösung recht träges Oxidationsmittel. So werden in verdünnter Lösung beispielsweise Chloride und Bromide nur sehr langsam oxidiert, während ihre dreimolare Lösung rostfreien Stahl zügig oxidiert.
Perbromsäure ist bis zu einer Konzentration von 6 mol/l selbst bei 100 °C stabil. Höher konzentrierte Lösungen zersetzen sich jedoch schnell zu Bromsäure und Sauerstoff.[1]
Verwendung
Durch Reaktion mit Natriumhydroxid kann Natriumperbromat gewonnen werden.[3]
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Kurt H. Stern: High Temperature Properties and Thermal Decomposition of Inorganic Salts with Oxyanions. CRC Press, 2000, ISBN 978-1-4200-4234-4, S. 224 (eingeschränkte Vorschau in der Google-Buchsuche).