Pelargonidin-3-O-glucosid
Pelargonidin-3-O-glucosid ist ein im Pflanzenreich vorkommender Farbstoff aus der Gruppe der Anthocyane. Die chemische Verbindung ist aus den Molekülen Pelargonidin und Glucose zusammengesetzt, welche durch eine glycosidische Bindung verknüpft sind. Das Pelargonidin ist ein Kation; in den Pflanzen leitet sich das zugehörige Anion von Carbonsäuren (Fruchtsäuren) ab.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
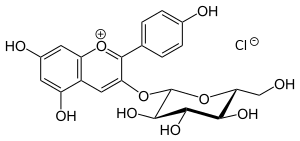 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Pelargonidin-3-O-glucosidchlorid | ||||||||||||
| Andere Namen |
Callistephinchlorid | ||||||||||||
| Summenformel | C21H21ClO10 | ||||||||||||
| Kurzbeschreibung |
brauner bis dunkelroter Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 468,84 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte

Der als ziegelrot beschriebene Farbstoff wurde von Richard Willstätter und Ch. L. Burdick aus der purpurroten Aster Callistephus chinensis L. isoliert und daher zunächst mit dem Trivialnamen Callistephin benannt.[2] Die Reinigung des Anthocyans war schwierig und mühsam. Daher wurde eine chemische Synthese versucht (siehe Allan-Robinson-Kondensation).[3]
Vorkommen
Die Farbe von Erdbeeren wird ebenfalls durch das Glucosid verursacht.[4][5] Neben weiteren Anthocyanidinen wurde Pelargonidin-3-O-glucosid in anderen Früchten nachgewiesen, z. B. in Himbeeren (Rubus idaeus),[6] in Rubus glaucus,[7] in der Blauen Heckenkirsche (Lonicera caerulea L.),[8] in der Kornelkirsche (Cornus mas L.). Auch koreanische Schwarze Bohnen (Phaseolus vulgaris L.) enthalten in der Haut Pelargonidin-3-O-glucosid.[9] Besondere Aufmerksamkeit wurde in neuerer Zeit dem Vorkommen in bunten Mais- (Zea mays L., cv Zihei) und Reis-Sorten geschenkt.[10]
Eigenschaften
Die zahlreichen OH-Gruppen machen das Molekül wasserlöslich. Verglichen mit den OH-Gruppen des Glucoserestes sind die phenolischen OH-Gruppen acider. In wässriger Lösung, wie in der Pflanzenzelle, stellt sich daher ein Gleichgewicht zwischen dem Pelargonidin-3-O-glucosid und seinen Anionen ein. Deren Farbe ist blau, und so zeigt Pelargonidin-3-glucosid in basischem Milieu diese Farbe; d. h., die Farbe von Blütenblättern oder Früchten kann je nach dem dort herrschenden pH-Wert variieren. Dadurch kann die Verbindung als pH-Indikator dienen. Außerdem wird die Farbe von Metall-Kationen beeinflusst.
Als Flavylium-Kation bildet Pelargonium-3-O-glucosid auch Salze mit ‚künstlichen‘ Säuren, welche Anionen liefern. So wurden zur Isolierung Salze mit Pikrinsäure und Salzsäure erzeugt (Pikrat bzw. Pelargonidin-3-glucosidchlorid). In der Infobox sind relevante Daten für das – käufliche – Chlorid angegeben.
Biosynthese
Bausteine der Biosynthese des Pelargonidin-3-glucosids sind p-Cumaroyl-Coenzym A und Malonyl-Coenzym A, welche 4,2',4',6'-Tetrahydroxychalcon liefern. Cyclisierung dieses Enons führt zum Pyranon, dem Naringenin. Dieses wird in 3-Stellung hydroxyliert; das Hydroxyketon Dihydrokaempferol ist die gemeinsame Zwischenstufe der Anthocyanidine Pelargonidin-3-O-glucosid, Cyanidin-3-O-glucosid und Delphinidin-3-O-glucosid.[11]
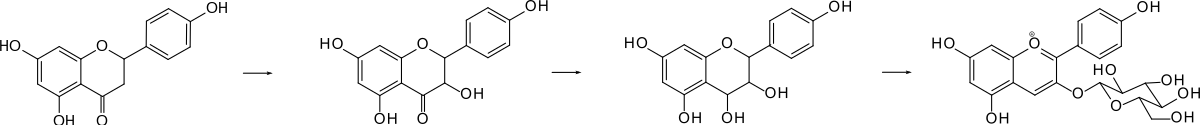
Letzte Stufen der Biosynthese. Von links nach rechts: Naringenin, Dihydrokaempferol, Leucopelargonidin, Pelargonidin-3-O-glucosid.
Biologische Bedeutung
Das Glucosid wirkt als Antioxidans und soll im menschlichen Körper Entzündungen hemmen.[12]
Nachweis
Pelargonidin-3-O-glucosid wurde zunächst durch Papierchromatographie nachgewiesen,[13] dann durch Flüssigkeitschromatographie (LC) in Kombination mit UV/VIS-Spektroskopie und Massenspektroskopie (MS).[14]
Einzelnachweise
- Datenblatt Pelargonidin-3-O-glucosid bei Sigma-Aldrich, abgerufen am 24. November 2021 (PDF).
- R. Willstätter, Ch. L. Burdick: XIII. Über zwei Anthocyane der Sommeraster. In: Justus Liebigs Annalen der Chemie. Band 412, Nr. 2, 1917, S. 149–164, doi:10.1002/jlac.19174120204.
- Alexander Robertson, Robert Robinson: CXCIII.—Experiments on the synthesis of anthocyanins. Part V. A synthesis of 3-β-glucosidylpelargonidin chloride, which is believed to be identical with callistephin chloride. In: Journal of the Chemical Society (Resumed). Nr. 0, 1. Januar 1928, S. 1460–1472, doi:10.1039/JR9280001460.
- Gertrude Maud Robinson, Robert Robinson: A survey of anthocyanins. II. In: Biochemical Journal. Band 26, Nr. 5, 1. Januar 1932, S. 1647–1664, doi:10.1042/bj0261647. Zitiert nach Ernest Sondheimer, Z. I. Kertesz: The Anthocyanin of Strawberries1. In: Journal of the American Chemical Society. Band 70, Nr. 10, 1. Oktober 1948, S. 3476–3479, doi:10.1021/ja01190a079.
- Ernest Sondheimer, Z. I. Kertesz: The Anthocyanin of Strawberries1. In: Journal of the American Chemical Society. Band 70, Nr. 10, 1. Oktober 1948, S. 3476–3479, doi:10.1021/ja01190a079.
- Christine M. Bradish, Penelope Perkins-Veazie, Gina E. Fernandez, Guoxiang Xie, Wei Jia: Comparison of Flavonoid Composition of Red Raspberries (Rubus idaeus L.) Grown in the Southern United States. In: Journal of Agricultural and Food Chemistry. Band 60, Nr. 23, 13. Juni 2012, S. 5779–5786, doi:10.1021/jf203474e.
- G.a. Garzón, K.m. Riedl, S.j. Schwartz: Determination of Anthocyanins, Total Phenolic Content, and Antioxidant Activity in Andes Berry (Rubus glaucus Benth). In: Journal of Food Science. Band 74, Nr. 3, 2009, S. C227–C232, doi:10.1111/j.1750-3841.2009.01092.x.
- Arusa Chaovanalikit, Maxine M. Thompson, Ronald E. Wrolstad: Characterization and Quantification of Anthocyanins and Polyphenolics in Blue Honeysuckle (Lonicera caerulea L.). In: Journal of Agricultural and Food Chemistry. Band 52, Nr. 4, 1. Februar 2004, S. 848–852, doi:10.1021/jf030509o.
- Myoung-Gun Choung, Byoung-Rourl Choi, Young-Nam An, Yong-Ha Chu, Young-Son Cho: Anthocyanin Profile of Korean Cultivated Kidney Bean (Phaseolus vulgaris L.). In: Journal of Agricultural and Food Chemistry. Band 51, Nr. 24, 1. November 2003, S. 7040–7043, doi:10.1021/jf0304021.
- Zhendong Yang, Weiwei Zhai. Identification and antioxidant activity of anthocyanins extracted from the seed and cob of purple corn (Zea mays L.). In: Innovative Food Science & Emerging Technologies, Jg. 2010, Bd. 11, Heft 1, S. 169-176. doi.org/10.1016/j.ifset.2009.08.012.
- Timothy A. Holton, Edwina C. Cornish: Genetics and Biochemistry of Anthocyanin Biosynthesis. In: The Plant Cell. Band 7, Nr. 7, Juli 1995, S. 1071–1083, PMID 12242398.
- Larissa Jeremias Duarte, Vitor Clasen Chaves, Marcus Vinicius Pereira dos Santos Nascimento, Eunice Calvete, Mingchuan Li, Elisa Ciraolo, Alessandra Ghigo, Emilio Hirsch, Claudia Maria Oliveira Simões, Flávio Henrique Reginatto, Eduardo M. Dalmarco. Molecular mechanism of action of Pelargonidin-3-O-glucoside, the main anthocyanin responsible for the anti-inflammatory effect of strawberry fruits. In: Food Chemistry, Jg. 2018, Bd. 247, S. 56-65. doi.org/10.1016/j.foodchem.2017.12.015.
- V. Jiracek, Z. Prochazka, Sauerstoffhaltige heterocyclische Verbindungen. Flavonoide. In: I. M. Hais, K. Macek, (Hrsg.), Handbuch der Papierchromatographie, 2. Aufl. Bd. 1, S. 286-423, Gustav Fischer Verlag, Jena 1963.
- Siehe z. B. Jean-Paul Goiffon, Pierre P Mouly, Emile M Gaydou. Anthocyanic pigment determination in red fruit juices, concentrated juices and syrups using liquid chromatography. In: Analytica Chimica Acta, Jg. 1999, Bd. 382, Heft 1–2, S. 39-50. doi.org/10.1016/S0003-2670(98)00756-9.